微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 我们生活在千变万化的物质世界里。下列变化中,没有发生氧化还原反应的是
[? ]
A.
B.
C.
D.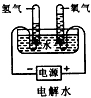
参考答案:C
本题解析:
解析:
选项A.爆竹爆炸,为炸药与氧气发生的剧烈的氧化还原反应,故A不选;
选项B.木炭燃烧,C、O元素的化合价变化,发生氧化还原反应,故B不选;
选项C.钢水浇铸,属于物质状态的变化过程,没有元素化合价的变化,不发生氧化还原反应,故C选;
选项D.电解水,H、O元素的化合价变化,发生氧化还原反应,故D不选。
故选:C.
本题难度:简单
2、选择题 氧化还原反应中实际上包含氧化和还原两个过程。某氧化还原反应的一个还原过程的反应式为:S2O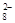 +2e-
+2e- 2SO
2SO ,该反应中另一重要反应物可能是KMnO4、Na2CO3、MnSO4、KNO3四种物质中的一种。下列有关说法正确的是( )
,该反应中另一重要反应物可能是KMnO4、Na2CO3、MnSO4、KNO3四种物质中的一种。下列有关说法正确的是( )
A.S2O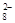 中S显+7价,说明S的最外层有7个电子
中S显+7价,说明S的最外层有7个电子
B.该反应中另一重要反应物为KMnO4
C.该反应的氧化过程可表示为:Mn2+-5e-+4H2O MnO
MnO +8H+
+8H+
D.若有5mol S2O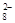 参与反应,溶液中会生成8 mol H+
参与反应,溶液中会生成8 mol H+
参考答案:C
本题解析:考查氧化还原反应的相关计算
A、S2O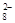 中S显+7价,但S的最外层有只有6个电子,化合价只是元素呈现的一种性质,与元素原子的最外层电子数没有必然的联系
中S显+7价,但S的最外层有只有6个电子,化合价只是元素呈现的一种性质,与元素原子的最外层电子数没有必然的联系
B、S2O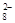 得电子,发生氧化反应,必然有另一物质失电子,它的元素化合价将升高,观察题目所给四种物质可看出,只有MnSO4中锰元素外于低价,可以被氧化,故该反应中另一重要反应物为MnSO4
得电子,发生氧化反应,必然有另一物质失电子,它的元素化合价将升高,观察题目所给四种物质可看出,只有MnSO4中锰元素外于低价,可以被氧化,故该反应中另一重要反应物为MnSO4
C、正确(可先写出总的氧化还原反应方程式,减去题目所给还原反应即可得到)
D、根据电子的得失守恒,若有5mol S2O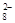 参与反应,转移的电子数为10 mol,由氧化过程可知,溶液中会生成16 mol H+
参与反应,转移的电子数为10 mol,由氧化过程可知,溶液中会生成16 mol H+
故答案为C
本题难度:一般
3、选择题 将磁性氧化铁放入稀HNO3中可发生如下反应:3Fe3O4 + 28HNO3 = 9Fe(NO3)x + NO↑+ 14H2O下列判断合理的是
[? ]
A.Fe(NO3)x中的x为2
B.反应中每还原0.4 mol氧化剂,就有1.2 mol电子转移
C.稀HNO3在反应中只表现氧化性
D.磁性氧化铁中的所有铁元素全部被氧化
参考答案:B
本题解析:
本题难度:简单
4、填空题 下列过程中涉及氧化还原反应的是
[? ]
A.氯气通入水中制氯水
B.四氯化碳萃取碘水中的碘
C.过滤除去粗盐中的不溶性杂质
D.蒸馏法将海水淡化为饮用水
参考答案:A
本题解析:
本题难度:简单
5、选择题 在5.6 g Fe粉中加入过量的稀硫酸溶液,待反应完全后,再加入1mol·L-1 KNO3溶液25mL,恰好反应完全。该反应的方程式为:
FeSO4 +KNO3 +H2SO4→K2SO4 +Fe2(SO4)3+NxOy?+ H2O(未配平),则对该反应的下列说法正确的是
A.化学方程式中按物质顺序的计量数是:8、2、5、1、4、1、5
B.反应中氧化产物是N2O
C.反应过程中转移的电子数为8mol电子
D.氧化产物和还原产物的物质的量之比为4∶1
参考答案:AD
本题解析:该反应中,Fe2+失电子Fe3+,所以硫酸亚铁作还原剂;硝酸钾中氮元素得电子化合价降低作氧化剂;硫酸亚铁的物质的量0.1mol,所以硫酸亚铁生成硫酸铁失去0.1mol电子;根据氧化还原反应中得失电子数相等可知,硝酸钾中氮元素得到0.1mol电子,KNO3物质的量为0.025mol,则0.025*(5-2Y/X)=0.1即X=2Y,按照A的配平系数带入答案,经过验证,所以该氮的氧化物是N2O,应该是还原产物,A正确,BC错误;氧化产物是Fe2(SO4)3和还原产物N2O的物质的量之比为4∶1,正确;
本题难度:一般