微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 氟碳铈矿主要化学成分为CeFCO3,它是提取铈族稀土元素的重要矿物原料.氟碳铈矿的冶炼处理工艺已经发展到十数种,其中一种提取铈的工艺流程如下:
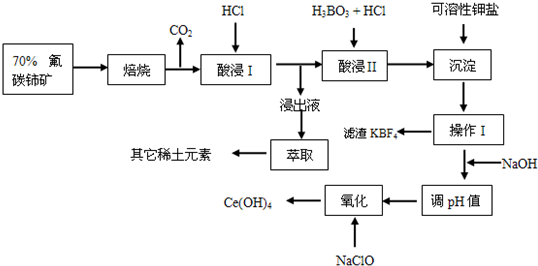
已知:焙烧后烧渣中含+4价的铈及+3价的其它稀土氟氧化物;酸浸I的浸出液中含少量的+3价的铈
请回答下列问题
(1)焙烧前将矿石粉碎成细颗粒的目的是______.
(2)酸浸II后,四价铈转化为三价,为了避免三价铈以四氟硼酸盐形式损失,用可溶性钾盐将四氟硼酸根沉淀除去,该反应的离子方程式为:______
(3)在生产过程中,酸浸I?中会产生大量黄绿色气体,污染环境、腐蚀设备,写出产生黄绿色气体的离子方程式:______,提出一种解决的方案:______.
(4)实验室中进行操作I所用玻璃仪器名称:______;在操作I后的溶液中加入NaOH溶液是为了调节溶液pH值获得Ce(OH)3,测定该溶液pH值的操作是______.
(5)写出氧化步骤的化学方程式:______,其中还原产物是______.
参考答案:(1)对于固体参加的反应来说,固体表面积越大,反应速率越大,故答案为:增大固体与空气的接触面积,增大反应速率;提高原料的利用率;
(2)根据题意可知应为KBF4沉淀,故答案为:K++BF4-=KBF4↓;
(3)在生产过程中,酸浸I中会产生大量黄绿色气体,说明Ce4+离子具有强氧化性,可将Cl-氧化为Cl2,为避免污染环境、腐蚀设备,应用硫酸酸浸,故答案为:2Ce4++2Cl-=2Ce3++Cl2↑;用H2SO4酸浸;
(4)过滤用到的仪器有铁架台、烧杯、漏斗、玻璃棒和滤纸等;实验室测定PH的方法是撕下一小片pH试纸放在干燥洁净的表面皿上,用玻璃棒蘸取该溶液点在pH试纸的中央,然后与标准比色卡对比;故答案为:漏斗、烧杯、玻璃棒;撕下一小片pH试纸放在干燥洁净的表面皿上,用玻璃棒蘸取该溶液点在pH试纸的中央,然后与标准比色卡对比;
(5)NaClO将Ce(OH)3氧化为Ce(OH)4,其中NaCl为还原产物,故答案为:2Ce(OH)3+NaClO+H2O=2Ce(OH)4+NaCl;?
NaCl.
本题解析:
本题难度:一般
2、推断题 已知A-I均为短周期元素组成的物质,其中B、F为金属单质,C、G为气体单质,E灼烧时的焰色呈黄色(图中有关条件和部分生成物没有列出)。
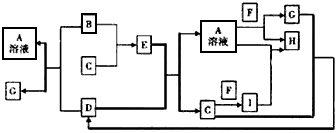
(1)写出I的化学式____________,E的电子式__________________。
(2)写出E+D→A+C的化学方程式________________________。
(3)写出有关反应的离子方程式:
B+D→A+G______________________。 A+F→G+H_______________________。
(4)H溶液呈_____性(填“酸”、“碱”、“中”),请用离子方程式表示其原因________________。
参考答案:(1)Al2O3;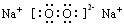
(2)2Na2O2+2H2O==4NaOH+O2↑
(3)2Na+2H2O==2Na++2OH-+H2↑;2Al+2OH-+2H2O==2AlO2-+3H2↑
(4)碱;AlO2-+2H2O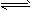 Al(OH)3+OH-
Al(OH)3+OH-
本题解析:
本题难度:一般
3、填空题 (11分)A、D、E、M、L是原子序数依次增大的五种短周期元素。已知A是元素周期表中原子半径最小的元素;D的某种单质是天然存在的最硬物质;E是地壳中含量最多的元素;M与A位于同一主族;L与M能够形成ML型离子化合物。回答下列问题:
(1)元素D在元素周期表中的位置是?。
(2)L的单质与M的最高价氧化物对应水化物反应的离子方程式为?。
(3)由A、D组成的最简单化合物甲的二氯化物有?种。人们已经研究出以甲为燃料的新型碱性燃料电池,写出该电池正极的电极反应式为:?。
(4)已知反应:DE(g)+A2E(g) DE2(
DE2( g)+A2(g),
g)+A2(g),

一定条件下该反应进行过程中的能量变 化如上图表示,请结合上图判断:该反应△H?0(填“>”、“<”或“=”)。该反应的平衡常数表达式为:K=?
化如上图表示,请结合上图判断:该反应△H?0(填“>”、“<”或“=”)。该反应的平衡常数表达式为:K=? ?。
?。
(5)25℃时,物质的量浓度相同的MEA、MADE3、MLE三种溶液,水的电离程度由大到小的顺序为?。
参考答案:(11分)

本题解析:略
本题难度:一般
4、简答题 A~F是中学化学中常见物质,常温下A、C、E、F为气体,B、D为液体,其中B的分子为4原子分子,D在常温下不具有挥发性.F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末.这些物质之间满足如下图所示的转化关系,图中部分生成物已略去.

(1)写出下列物质的化学式:A______,F______.
(2)B的电子式是______.根据图中信息,B、C、X的氧化性由强到弱的顺序是______(用化学式表示).
(3)反应⑥的离子方程式是______.
(4)在反应⑥中,F表现的性质是______,当生成0.75molC时,被氧化的还原剂的物质的量是______.
参考答案:B、D为液体,其中B的分子为4原子分子,因此B是H2O2,D在常温下不具有挥发性,且D能和铜反应,这说明D应该是H2SO4,则根据A是气体可知A是SO2,F的浓溶液与X共热通常用于实验室制备单质C,且C、E、F为气体,由于H2O2易分解生成O2,这说明E应该是O2,则X就是MnO2,所以C是Cl2,F是HCl,
(1)由以上分析可知A为SO2,F为HCl,故答案为:SO2;HCl;
(2)B是H2O2,为共价化合物,电子式为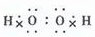 ,根据氧化还原反应中氧化剂的氧化性强于氧化产物的可知,B、C、X的氧化性由强到弱的顺序是MnO2>Cl2>H2O2,故答案为:
,根据氧化还原反应中氧化剂的氧化性强于氧化产物的可知,B、C、X的氧化性由强到弱的顺序是MnO2>Cl2>H2O2,故答案为: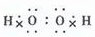 ;MnO2>Cl2>H2O2;
;MnO2>Cl2>H2O2;
(3)反应⑥是实验室制取氯气,反应的离子方程式是MnO2+4H++2Cl-△.Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-△.Mn2++Cl2↑+2H2O;
(4)在实验室制取氯气的反应中,浓盐酸表现出的性质是还原性和酸性.根据氯原子守恒可知,当生成0.75mol 氯气时,被氧化的还原剂的物质的量是0.75mol×2=1.5mol,
故答案为:还原性、酸性;1.5mol.
本题解析:
本题难度:简单
5、实验题 (8分)现有四瓶丢失标签的NaOH、Na2CO3、AlCl3、NH4HSO4溶液,为鉴别四瓶溶液,将四瓶溶液编号为A、B、C、D进行实验。实验过程记录如下: B逐滴加入A中先产生白色沉淀X,继续加入B沉淀消失得无色溶液W;B与C中混合加热得无色气体Y,将Y通入紫色的石蕊试液中,石蕊试液变蓝;C和D以2:1混合得无色无味的气体Z,将Z通入紫色的石蕊试液,石蕊试液变红。根据实验现象请回答:
(1)Y、Z的化学式分别为:Y?;Z??
X与B反应的离子方程式为?。
(2)D溶液pH?(填“大于”、“小于”或“等于”)7,原因是(用离子方程式表示):?。
(3)等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是?。(用化学式表示)
(4)请写出C与过量B反应(加热)的离子方程式?。
参考答案:(8分)(1)NH3;? CO2;? Al(OH)3+OH-=AlO2-+2H2O
(2)大于;? CO32-+H2O HCO3-+OH-
HCO3-+OH-
(3)NaOH>Na2CO3>AlCl3>NH4HSO4(以上每空1分)
(4)NH4++H++2OH-=NH3↑+2H2O(2分)
本题解析:(1)B逐滴加入A中先产生白色沉淀X,继续加入B沉淀消失得无色溶液W,可推知,A为AlCl3,B为NaOH,X为Al(OH)3,w为NaAlO2,离子方程式为Al3++OH-= Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O。B与中混合加热得无色气体Y,将Y通入紫色的石蕊试液中,石蕊试液变蓝,可推知,C为NH4HSO4,Y为NH3,D为Na2CO3。C和D以2:1混合得无色无味的气体Z,将Z通入紫色的石蕊试液,石蕊试液变红,可推知,Z为CO2。(2)Na2CO3是强碱弱酸盐,溶于水发生水解,离子方程式为CO32-+H2O HCO3-+OH-,呈碱性,PH>7。(3)NaOH是强碱,PH最大,Na2CO3是强碱弱酸盐类,Na2CO3水解呈碱性,AlCl3是强酸弱碱盐,AlCl3水解呈酸性性,NH4HSO4电离出H+呈强酸性,因此PH顺序为NaOH>Na2CO3>AlCl3>NH4HSO4。(4)NH4HSO4电离方程式为,NH4HSO4=NH4++H++SO42-。
HCO3-+OH-,呈碱性,PH>7。(3)NaOH是强碱,PH最大,Na2CO3是强碱弱酸盐类,Na2CO3水解呈碱性,AlCl3是强酸弱碱盐,AlCl3水解呈酸性性,NH4HSO4电离出H+呈强酸性,因此PH顺序为NaOH>Na2CO3>AlCl3>NH4HSO4。(4)NH4HSO4电离方程式为,NH4HSO4=NH4++H++SO42-。
点评:试剂滴加的顺序和多少对化学反应都有影响,注意对量的分析。识记一些常用的实验现象,气体通入紫色的石蕊试液中,石蕊试液变蓝的是碱性气体。气体通入紫色的石蕊试液,石蕊试液变红是酸性气体。
本题难度:一般