微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物,实验室以孔雀石为原料制备CuSO4?5H2O及CaCO3,步骤如下:
试回答下列问题:
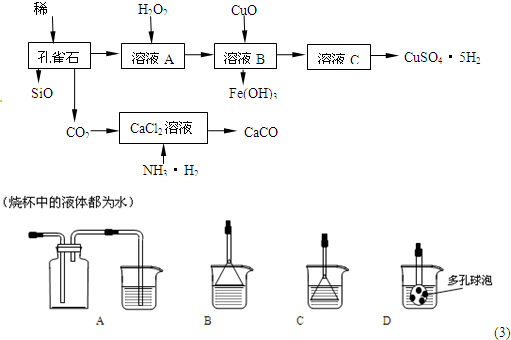
(1)在未加入H2O2的溶液A中,存在的金属离子有Cu2+、Fe2+、Fe3+.若检验该溶液中Fe3+,选择最合适的试剂是______(填代号).
A.KMnO4溶液 B.Fe粉?C.?Na2CO3溶液?D.KSCN溶液
向溶液A中加入H2O2,H2O2在该反应中作氧化剂.实验室选用H2O2而不用Cl2作氧化剂.除考虑环保因素外,另一原因是不引入杂质______离子.
(2)由溶液C获得CuSO4?5H2O,需要经过加热浓缩,______,过滤等操作.除烧杯、漏斗外,过滤操作还需用到另一玻璃仪器,该仪器在此操作中的主要作用是______.
(3)制备CaCO3时,发生反应的化学方程式是______;若实验过程中有氨气逸出,可选用下列装置中的______(填代号)装置吸收氨气.
(4)欲测定溶液A中Fe2+的浓度,需配制100mL?0.1mol∕LKMnO4标准溶液.配制该溶液时:除烧杯、玻璃棒、胶头滴管外,还需的一种玻璃仪器是______;当往该玻璃仪器中加蒸馏水至接近刻度线1-2cm时,应改用______滴加蒸馏水至溶液的凹液面正好与刻度线相平.
参考答案:(1)若检验溶液中Fe3+,使用的试剂是KSCN溶液,溶液变成血红色,是Fe3+的特征反应,由
H2O2+2Fe2++2H+=2Fe3++2H20、Cl2+2Fe2+=2Fe3++2Cl-,H2O2与Fe2+反应生成的H20为溶剂,Cl2与Fe2+反应
生成的Cl-是杂质离子,故答案为:D;Cl-;
(2)由溶液制取晶体,需经过加热浓缩,冷却结晶才可得到,在过滤操作中,除烧杯、玻璃棒、胶头滴管外,还需的一种玻璃仪器是玻璃棒,它的作用是引流.故答案为:冷却结晶;引流;
(3)二氧化碳和氯化钙不反应,氨气极易溶于水,使溶液呈碱性,和酸性氧化物二氧化碳反应生成碳酸铵,碳酸铵和氯化钙发生复分解反应,生成碳酸钙沉淀;氨气极易溶于水,且氨气有刺激性气味,防止污染大气,要有尾气处理装置,选用倒置的漏斗且紧贴水面,目的是防止倒吸.故答案为:CO2+CaCl2+2NH3?H2O=CaCO3↓+2NH4Cl+H2O;B;
(4)一定物质的量浓度溶液的配置,除烧杯、玻璃棒、胶头滴管外,还需的一种玻璃仪器是容量瓶,容量瓶的规格有100ml、250ml、500ml、1000ml,选取容量瓶的规格应大于等于配置溶液的体积,当往该玻璃仪器中加蒸馏水至接近刻度线1-2cm时,应改用胶头滴管滴加蒸馏水,故答案为:100mL容量瓶; 胶头滴管.
本题解析:
本题难度:一般
2、简答题 甲、乙、丙、丁为四种常见单质,常温下,乙、丙、丁为气体.丙常用于自来水消毒,甲是生活中常见金属,A在通常情况下为无色液体,B、C在溶液中反应.
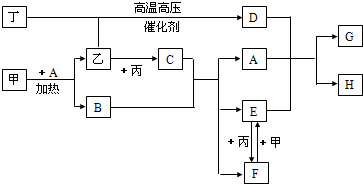
(1)D的化学式为______;闻气体丙的正确方法是______;取少量长期放置的丙的水溶液,滴入几滴石蕊试液,可观察到的现象是______.
(2)甲+A反应的化学方程式为______.
(3)F+甲反应的离子方程式为______;该反应中,证明甲适量或过量的方法是______.
(4)A+D+E反应的离子方程式为______;该反应能顺利进行,是利用了D的______的性质;若反应在试管中进行一,则其现象为______.
参考答案:丙常用于自来水消毒,应为Cl2,A在通常情况下为无色液体,应为H2O,甲是生活中常见金属且能与水在加热条件下反应,则甲为Fe,乙为H2,B为Fe3O4,C为HCl,由转化关系可知E为FeCl2,F为FeCl3,丁与氢气在高温、高压、催化剂作用下反应,应是合成氨的反应,则丁为N2,D为NH3,D、A、E反应生成Fe(OH)2和NH4Cl,
(1)由以上分析可知D为NH3,丙为Cl2,有毒,闻气味时应用手在瓶口轻轻煽动,使极少量气体飘进鼻孔,长期放置氯水,由于HClO分解生成HCl,则滴入几滴石蕊试液,溶液变红,
故答案为:NH3;扇闻;溶液变红;
(2)Fe和水在高温下发生反应生成四氧化三铁和氢气,反应的方程式为3Fe+4H2O?△?.?Fe3O4+4H2,故答案为:3Fe+4H2O?△?.?Fe3O4+4H2;
(3)F+甲为FeCl3和Fe的反应,反应的离子方程式为2Fe3++Fe=3Fe2+,如Fe过量,则溶液中不存在Fe3+,可用KSCN溶液检验,操作方法为取少量反应后的溶液于试管中,滴入几滴KSCN溶液,若溶液不变色,说明甲过量或适量,
故答案为:2Fe3++Fe=3Fe2+;取少量反应后的溶液于试管中,滴入几滴KSCN溶液,若溶液不变色,说明甲过量或适量;
(4)D、A、E反应生成Fe(OH)2和NH4Cl,反应的离子方程式为Fe2++2NH3?H2O=Fe(OH)2↓+2NH4+,氨气极易溶于水,且溶液呈碱性,生成的白色絮状Fe(OH)2沉淀不稳定,易被空气中氧气氧化而迅速变成灰绿色,最后变成红褐色,
故答案为:Fe2++2NH3?H2O=Fe(OH)2↓+2NH4+;极易溶于水且溶于水后显碱性;先生成白色絮状沉淀,迅速变成灰绿色,最后变成红褐色.
本题解析:
本题难度:一般
3、简答题 A、B、C三种化合物,都是由氢、氮、氧三种元素所组成,其中一种是弱电解质,余均是强电解质.A和B可以通过复分解反应形成C.常温,浓度均为amol?L-1的A、B、C三种稀溶液中,pH大小关系是pH(B)>pH(C)>pH(A).
(1)写出物质的化学式:A:______B:______C:______.
(2)A、B、C三种物质各自溶解在水中时,能使水的电离程度增大的是______,对应的离子方程式为:______.
(3)若将a?mol?L-1的B溶液进行下列实验,将变化填写在对应表格中
| 项目 | 溶液中c(H+) | 溶液中c(OH-) | 对B电离的影响
取1mL用蒸馏水稀释为100mL溶液
取1mL用同浓度的C溶液稀释为100mL溶液
参考答案:(1)A、B、C三种化合物,都是由氢、氮、氧三种元素所组成,其中一种是弱电解质,推断为NH3?H2O,余均是强电解质.A和B可以通过复分解反应形成C.说明是酸和碱反应生成盐,可以推断AB为一水合氨和硝酸,反应生成硝酸铵,浓度均为amol?L-1的A、B、C三种稀溶液中,pH大小关系是pH(B)>pH(C)>pH(A).则A为HNO3;B为NH3?H2O;C为NH4NO3;
故答案为:HNO3,NH3?H2O,NH4NO3;
(2)A、B、C三种物质各自溶解在水中时,能使水的电离程度增大的是硝酸铵,铵根离子水解显酸性,反应的离子方程式为:NH4++H2O?NH3.H2O+H+;
故答案为:C;NH4++H2O?NH3.H2O+H+;
(3)若将a mol?L-1的B为NH3?H2O溶液进行下列实验,稀释促进一水合氨的电离平衡正向进行,平衡状态下的离子浓度减小,依据水溶液中的离子积常数氢氧根离子浓度增大,氢离子浓度减小;取1mL用同浓度的C溶液为NH4NO3稀释为100mL溶液,溶液中存在铵根离子对一水合氨的电离起到了抑制作用,氢氧根离子浓度减小,溶液中氢离子浓度增大;
故答案为:
项目c(H+)c(OH-)对B电离的影响取1mL用蒸馏水稀释为100mL溶液增大减小促进取1mL用同浓度的C溶液稀释为100mL溶液增大减小抑制
本题解析:
本题难度:一般
4、填空题 ( 10分?)A~I分别表示中学化学中常见的一种物质,其中A、I为常见金属,它们之间的相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六各物质中均含同一种元素,F是红褐色固体。

请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素是?。
(2)写出下列反应的化学方程式或离子方程式:
反应①的化学方程式:?;
反应④的离子方程式:?;
反应⑥的化学方程式:?;
(3)从能量变化的角度看,反应①②③中,属于△H<0的反应是?(填序号)。
参考答案:(10分,每空2分)
(1)铁(或Fe)(2)8Al+3Fe3O4  4Al2O3+9Fe 4Al2O3+9Fe
2Al+2OH- +2H2O =2AlO2-+3H2↑? 4Fe(OH)2+O2+2H2O=4Fe(OH)3?(3) ①②
本题解析:根据物质的状态及反应条件可知,反应①为铝热反应,A为铁:8Al+3Fe3O4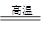 4Al2O3+9Fe;B即为Fe3O4与盐酸反应:Fe3O4+8HCl=2FeCl3+FeCl2+4H2O; 4Al2O3+9Fe;B即为Fe3O4与盐酸反应:Fe3O4+8HCl=2FeCl3+FeCl2+4H2O;
而G必定为氧化铝,电解得到铝:2Al2O3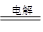 4Al+3O2↑; 4Al+3O2↑;
(1)A、B、C、D、E、F六种物质中所含的同一种元素是铁元素
(2)①8Al+3Fe3O4  4Al2O3+9Fe; 4Al2O3+9Fe;
④2Al+2OH- +2H2O =2AlO2-+3H2↑
⑥4Fe(OH)2+O2+2H2O=4Fe(OH)3
(3)反应①②均为放热反应,△H<0,而③需要提供电能,或者可以认为是铝燃烧的逆反应,必定是吸热反应,△H>0
本题难度:一般
5、推断题 A、B、C是单质,x、Y、Z、H、?J、?L是化合物,B在空气中燃烧也可得X和J,x和J都是固体。在适当的条件下,它们相互之间有下图所示的转化关系。

(1) 单质C是_______,化合物L是________?(填化学式)
(2) 写出反应①、⑤的化学方程式:? 反应①:_______________ 反应⑤:________________
参考答案:(1)H2? ;NO?
(2)反应①:N2+3Mg Mg3N2 Mg3N2
反应⑤:4NH3+5O2 4NO+6H2O 4NO+6H2O
本题解析:
本题难度:一般
|