微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期,其相关信息如下表:
元素
| 相关信息
|
X
| X的最高价氧化物对应的水化物化学式为H2XO3
|
Y
| Y是地壳中含量最高的元素
|
Z
| Z的基态原子最外层电子排布式为3s23p1
|
W
| W的一种核素的质量数为28,中子数为14
|
(1)W位于元素周期表第 周期第 族;W的原子半径比X的
(填“大”或“小”)。
(2)Z的第一电离能比W的 (填“大”或“小”);XY2由固态变为气态所需克服的微粒间作用力是 。氢元素、X、Y的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称 。
(3)振荡下,向Z单质与盐酸反应后的无色溶液中滴加NaOH溶液直至过量,能观察到的现象是 ;W的单质与氢氟酸反应生成两种无色气体,该反应的化学方程式是 。
(4)在25℃、101kPa下,已知13.5g的Z固体单质在Y2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式是 。
参考答案:(1)3 IVA 大;
(2)小 分子间作用力 乙醇
(3)先生成白色沉淀,后沉淀逐渐溶解,最后变成无色溶液;Si+4HF=SiF4+H2↑
(4)4Al(s)+3O2(g)=2Al2O3(s) △H=-1676kJ/mol
本题解析:根据题意知,X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期,Y是地壳中含量最高的元素,则Y为氧元素;X的最高价氧化物对应的水化物化学式为H2XO3,最高正化合价为+4,处于ⅣA族,原子序数小于氧元素,故X为碳元素;Z的基态原子最外层电子排布式为3s23p1,处于第三周期第ⅢA族,则Z为Al元素;W的一种核素的质量数为28,中子数为14,其质子数=28-14=14,故W为Si元素,
(1)W为Si元素,Si原子核外有3个电子层,最外层电子数为4,处于周期表中第三周期第ⅣA族;同主族自上而下原子半径增大,则原子半径Si>C。
(2)同周期自左而右元素的第一电离能呈增大趋势,故第一电离能Al<Si;CO2固态属于分子晶体,由固态变为气态所需克服的微粒间作用力是分子间作用力;氢元素、C、O的原子可共同形成多种分子,能形成同种分子间氢键的物质含有羟基或羧基,如乙醇等。
(3)Al单质与盐酸反应后的无色溶液为氯化铝溶液,振荡下,向氯化铝溶液中滴加NaOH溶液直至过量,首先反应生成氢氧化铝,然后氢氧化铝与氢氧化钠反应生成偏铝酸钠,故能观察到的现象是:先生成白色沉淀,后沉淀逐渐溶解,最后变成无色溶液;Si的单质与氢氟酸反应生成四氟化硅与氢气,反应方程式为:Si+4HF=SiF4↑+2H2↑。
(4)热化学方程式为:4Al(s)+3O2(g)=2Al2O3(s) △H=-1676kJ/mol
本题难度:困难
2、选择题 下列化合物中,化学键的类型和分子的极性(极性或非极性)皆相同的是( )
A.CO2和SO2
B.CH4和SiO2
C.BF3和NH3
D.HCl和HI
参考答案:D
本题解析:A中都是极性键,但CO2是非极性分子,SO2是极性分子;B中都是极性键,但二氧化硅是原子晶体;C中都是极性键,BF3是非极性分子,氨气是极性分子;D中都是极性键,都属于极性分子,答案选D。
点评:该题是中等难度的试题,主要是考查学生对化学键与分子极性的了解掌握情况。该题的关键是明确化学键的含义以及判断依据,特别是分子空间构型的特点,然后灵活运用即可。有利于培养学生的逻辑思维能力和空间想象能力。
本题难度:一般
3、简答题 (12分) (1)已知:蒸发1 mol Br2(l)需要吸收的能量为 30 kJ,其他相关数据如下表:
物质
| H2(g)
| Br2(g)
| HBr(g)
|
1 mol分子中化学键断裂时需要吸收的能量/kJ
| 436
| 200
| 369
|
H2(g)+Br2(l)=2HBr(g) ΔH= 。
(2)常温下,将pH均为2的氢溴酸、乳酸(α—羟基丙酸)稀释100倍后,有一种酸的pH=4。请写出乳酸钠溶液中的水解离子方程式: 。
(3)常温下,用0.100 0 mol·L-1 NaOH溶液分别滴定20.00 mL 0.100 0 mol·L-1 HBr溶液和20.00 mL0.100 0 mol·L-1 CH3COOH溶液,得到2条滴定曲线,如图所示: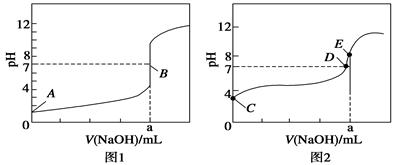
①根据图1和图2判断,滴定HBr溶液的曲线是 (填“图1”或“图2”);
②a= mL;
③c(Na+)=c(CH3COO-)的点是 点;
④E点对应溶液中离子浓度由大到小的顺序为 。
参考答案:(1)-72 kJ·mol-1 (2)CH3CH(OH)COO- + H2O CH3CH(OH)COOH +OH-
CH3CH(OH)COOH +OH-
(3)① 图1 ②20.00 ③ D ④c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
本题解析:(1)化学反应中化学键断裂吸收能量,形成化学键放出能量,反应热等于反应物的总键能减生成物的总键能。由化学键的键能可知H2(g)+Br2(g)=2HBr(g)△H=(436kJ/mol+200kJ/mol)-2×(369kJ/mol)=-102kJ/mol,因蒸发1mol Br2(l)需要吸收的能量为30kJ,则H2(g)+Br2(l)=2HBr(g)△H为=(-102kJ/mol)+(+30kJ/mol)=-72 kJ/mol。
(2)常温下,将pH均为2的氢溴酸、乳酸(α—羟基丙酸)稀释100倍后,由于氢溴酸是强酸,因此有一种酸的pH=4,则该酸一定是氢溴酸,这说明乳酸是弱酸,所以乳酸钠溶液中的水解离子方程式为CH3CH(OH)COO- + H2O CH3CH(OH)COOH +OH-。
CH3CH(OH)COOH +OH-。
(3)①如果酸为强酸,则0.1000mol/L酸的pH为1,根据酸的初始pH知,图1为氢溴酸滴定曲线,。
②滴定20.00mL 0.1000mol/L 氢溴酸溶液,NaOH和HBr恰好反应时,消耗20mlNaOH溶液,生成强酸强碱盐,溶液呈中性,滴定终点时n(HBr)=n(NaOH),则a=20.00mL。
③c(Na+)=c(CH3COO-),溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以c(OH-)=c(H+),则溶液呈中性,pH=7,故答案为:D。
④根据图1知,a点氢氧化钠溶液的体积是20mL,酸和碱的物质的量相等,二者恰好反应生成盐,醋酸钠为强碱弱酸盐,其溶液呈碱性,所以c(OH-)>c(H+),溶液中存在电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以c(Na+)>c(CH3COO-),盐类水解程度较小,所以c(CH3COO-)>c(OH-),则溶液中离子浓度大小顺序是c(Na+)>c(CH3COO-)>c(OH-)>c(H+)。
考点:考查反应热计算、水解方程式、酸碱中和反应滴定曲线的有关判断
本题难度:困难
4、选择题 固体乙醇晶体中不存在的作用力是( )
A.离子键
B.氢键
C.非极性键
D.范德华力
参考答案:A
本题解析:固体乙醇形成的晶体类型是分子晶体,含有的作用力有氢键、非极性键、极性键和范德华力,但不存在离子键,答案选A。
点评:该题是基础性试题的考查,侧重对学生基础知识的巩固和训练。主要是考查学生对晶体类型以及微粒间作用力的了解掌握情况,注重巩固基础,提高能力。
本题难度:简单
5、选择题 已知H2(g)+Br2(l)=2HBr(g) ΔH=-72kJ·mol-1,蒸发1mol 液溴变Br2(g)需要吸收的能量为30kJ,其它相关数据如下表:
| H2(g)
| Br2(g)
| HBr(g)
|
1mol分子中的化学键断裂时需要吸收的能量/kJ
| 436
| a
| 369
|
则表中a为
A.404 B.260 C.230 D.200
参考答案:D
本题解析:蒸发1mol 液溴变Br2(g)需要吸收的能量为30kJ,根据ΔH=反应物的总键能-生成物的总键能="436+a+30-2×369=" -72,解得a=200,答案选D。
考点:考查化学反应的热效应与键能的关系
本题难度:一般