微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列中心原子的杂化轨道类型和分子几何构型不正确的是( )
A.PCl3中P原子sp3杂化,为三角锥形
B.BCl3中B原子sp2杂化,为平面三角形
C.CS2中C原子sp杂化,为直线形
D.H2S分子中,S为sp杂化,为直线形
参考答案:D
本题解析:根据价层电子对互斥理论可知,A中P原子含有(5-3×1)÷2=1对孤对电子,所以三角锥形结构,A正确;同样分析选项BC正确;D中S原子含有的孤对电子对数=(6-2×1)÷2=2对,所以H2S是V形结构,S原子sp3杂化,D不正确,答案选D。
点评:该题是中等难度的试题,试题难易适中,贴近高考。侧重对学生解题能力和方法的培养与训练,有利于培养学生的逻辑思维能力和抽象思维能力。该题的关键是准确判断出分子中中心原子的孤对电子对数,然后结合题意灵活运用分析即可。
本题难度:一般
2、填空题 氮是地球上含量丰富的原子元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)25℃时,0.1mol/LNH4NO3溶液中水的电离程度?(填“大于”、“等于”或“小于”) 0.1mol/L NaOH溶液中水的电离程度。
(2)若将0.1mol/L NaOH溶液和0.2mol/LNH4NO3溶液等体积混合,混合溶液中2c(NH4+)>c(NO3-),所得溶液中离子浓度由大到小的顺序是?。
(3)发射火箭时肼(N2H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。经测定16g气体在上述反应中放出284kJ的热量。则该反应的热化学方程式是?。
(4)下图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图。
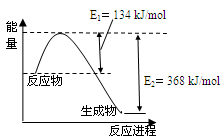
已知:N2(g)+O2(g)=2NO(g)?△H=+180kJ/mol
2NO (g)+O2(g)=2NO2(g)?△H=-112.3kJ/mol
则反应:2NO(g)+2CO(g) N2(g)+2CO2(g)的△H是?。
N2(g)+2CO2(g)的△H是?。
参考答案:(1)大于?(2)c(NO3-)>c(NH4+)>c(Na+)>c(OH-)>c(H+)
(3)2N2H4(g)+2NO2(g)=3N2(g)+2H2O (g)?△H=-1136kJ/mol(4)-760.3kJ/mol
本题解析: (1)酸、碱抑制水的电离、能水解的盐促进水的电离。
(2)0.1mol/L NaOH溶液和0.2mol/LNH4NO3溶液等体积混合后c(Na+)=0.05mol/L、c(NO3-)=0.1mol/L,由2c(NH4+)>c(NO3-)得c(NH4+)>0.05mol/L。电荷守恒式为c(Na+)+c(NH4+)+c(H+)=c(NO3-)+c(OH-),由c(Na+)、c(NO3-)、c(NH4+)得c(OH-)>c(H+)。所以c(NO3-)>c(NH4+)>c(Na+)>c(OH-)>c(H+)。
(3)2N2H4+2NO2=3N2+2H2O,16gN2H4为0.5mol,所以2molN2H4反应放热1136kJ。
(4)由图像可得NO2(g)+CO(g) CO2(g)+NO(g)?△H=-234kJ/mol。由盖斯定律得2NO(g)+2CO(g)
CO2(g)+NO(g)?△H=-234kJ/mol。由盖斯定律得2NO(g)+2CO(g) N2(g)+2CO2(g)的△H=-(234×2+180+112.3)kJ/mol=-760.3kJ/mol。
N2(g)+2CO2(g)的△H=-(234×2+180+112.3)kJ/mol=-760.3kJ/mol。
本题难度:一般
3、选择题 下列反应的离子方程式书写正确的是
A.向饱和碳酸氢钙溶液中加入过量的氢氧化钠溶液 Ca2++HCO3-+OH-=CaCO3↓+H2O
B.向偏铝酸钠溶液中通入过量二氧化碳气体 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
C.碳酸钡溶于醋酸溶液 BaCO3+2H+=Ba2++CO2↑+H2O
D.在三氯化铁的酸性溶液中通入足量的硫化氢 2Fe3++S2-=2Fe2++S↓
参考答案:B
本题解析:分析:A、向饱和碳酸氢钙溶液中加入过量的氢氧化钠溶液是,碳酸氢钙会完全反应;
B、向偏铝酸钠溶液中通入过量二氧化碳气体会生成氢氧化铝和碳酸氢钠;
C、醋酸是弱酸,在离子方程式中不能拆成离子的形式;
D、氢硫酸是弱酸,在离子方程式中不能拆成离子的形式.
解答:A、向饱和碳酸氢钙溶液中加入过量的氢氧化钠溶液是,碳酸氢钙会完全反应,求钙离子和碳酸氢根按照物质的量之比是1:2进行反应,极Ca2++2HCO3-+2OH-=CaCO3↓+H2O+CO32-,故A错误;
B、向偏铝酸钠溶液中通入过量二氧化碳气体会生成氢氧化铝和碳酸氢钠,实质是:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故B正确;
C、醋酸酸性强于碳酸,碳酸钡溶于醋酸溶液发生反应的实质为:BaCO3+2CH3COOH=Ba2++CO2↑+H2O+2CH3COO-,故C错误;
D、硫化氢显酸性,并且硫有还原性,三价铁具有氧化性,在三氯化铁的酸性溶液中通入足量的硫化氢会发生氧化还原反应:2Fe3++H2S═2Fe2++S↓+2H+,故D错误.
故选B.
点评:本题是一道关于离子方程式书写正误的判断题,是现在考试的热点,难度不大.
本题难度:困难
4、选择题 下列各组物质中化学键的类型完全相同的是( )
A.NH3 H2O CO2
B.H2O Na2O CO2
C.CaCl2 NaO HH2O
D.HCl MgCl2 NH4Cl
参考答案:A、NH3、H2O、CO2均为共价化合物,化学键类型相同,故A正确;
B、H2O、CO2均为共价化合物,Na2O为离子化合物,所以H2O、Na2O、CO2化学键类型不同,故B错误;
C、NaO、CaCl2均为离子化合物,H2O为共价化合物,所以NaO、CaCl2、H2O化学键类型不同,故C错误;
D、HCl为共价化合物,MgCl2 、NH4Cl均为离子化合物,所以HCl、MgCl2 、NH4Cl化学键类型不同,故D错误;
故选A.
本题解析:
本题难度:简单
5、选择题 已知:①1molH2分子中化学键断裂时需要吸收436kJ的能量 ②1molCl2分子中化学键断裂时需要吸收243kJ的能量 ③由H原子和Cl原子形成1molHCl分子时释放431kJ的能量。 下列叙述正确的是
[? ]
A.氢气与氯气反应生成2mol氯化氢气体,需要释放183kJ的热量
B.氢气与氯气反应生成2mol氯化氢气体,需要吸收183kJ的热量
C.氢气与氯气反应生成1mol氯化氢气体,需要吸收183kJ的热量
D.氢气与氯气反应生成1mol氯化氢气体,需要释放183kJ的热量
参考答案:A
本题解析:
本题难度:一般