| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《化学反应与能量》试题强化练习(2017年最新版)(六)
参考答案:D 本题解析:理清常见放热反应:①可燃物的燃烧;②酸碱中和反应;③大多数化合反应;④金属与酸的置换反应;⑤铝热反应等;常见吸热反应:①大多数分解反应;②盐的水解;③Ba(OH)2·8H2O与NH4Cl反应;④碳与水蒸气、C与CO2的反应。选D 本题难度:一般 2、选择题 下列热化学方程式书写及说法正确的是 |
参考答案:D
本题解析:A.热化学方程式中,焓变的单位是kJ·mol-1,错误;B.燃烧热是指1moL物质完全燃烧生成稳定的化合物时放出的热量,碳的稳定生成物是二氧化碳,错误;C.氢氧化钡与硫酸反应生成水外,还有硫酸钡沉淀,所以,任何强酸和强碱发生中和反应生成1mol H2O(l)的反应热不都等于-a kJ·mol-1,错误;D.正确;选D。
考点:考查热化学方程式正误判断。
本题难度:一般
3、选择题 下列物质只含离子键的是
A.H2O
B.Na2O
C.NaOH
D.HCl
参考答案:B
本题解析:一般活泼的金属元素与活泼的非金属元素形成离子键,非金属元素之间形成共价键,以此来解答。A、H2O中只含H、O之间形成的共价键,故A不选;B、氧化钠中含钠离子、氧离子形成的离子键,故B选;C、NaOH中含钠离子、氢氧根离子形成的离子键和H、O之间形成的共价键,故C不选;D、氯化氢中只含H、Cl之间形成的共价键,故D不选;故选B。
本题难度:一般
4、选择题 从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4═3Br2+3Na2SO4+3H2O,与该反应在氧化还原反应原理上最相似的是
A.2NaBr+Cl2═2NaCl+Br2
B.C+CO22CO
C.2H2S+SO2═2H2O+3S↓
D.AlCl3+3NaAlO2+6H2O═4Al(OH)3↓+3NaCl
参考答案:BC
本题解析:分析:NaBr中的溴元素化合价为-1价,NaBrO3中溴元素的化合价为+5价,最后都生成了0价的溴单质,属于氧化还原反应中的归中反应类型.
解答:A.化合价变化的分别是溴元素和氯元素,不是归中反应类型,故A错误;
B.化合价变化的是碳元素,一种是有0价升高到+2价,一种是由 +4价降到+2价,是归中反应类型,故B正确;
C.硫元素的化合价从-2价升到0价,还有的从+4价降到0价,属于氧化还原反应中的归中反应类型,故C正确;
D.反应中没有元素化合价的变化,不是氧化还原反应,故D错误;
故选BC.
点评:本题考查学生分析和解决问题的能力,考查学生氧化还原反应知识,明确元素化合价是解本题关键,难度不大.
本题难度:简单
5、填空题 (10分)煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+H2O(g) 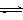 CO(g)+H2(g) ΔH=+131.3 kJ?mol-1,ΔS=+133.7J?(K?mol) -1
CO(g)+H2(g) ΔH=+131.3 kJ?mol-1,ΔS=+133.7J?(K?mol) -1
①该反应能否自发进行与__________有关;
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是__________(填字母,下同)。
a.容器中的压强不变 b.1 mol H—H键断裂的同时断裂2 molH—O键
c.v正(CO) = v逆(H2O) d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应 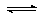 CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
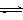 CH3OH(g)+H2O(g) ,右下图表示该反应进行过程中能量(单位为kJ?mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是___________。
CH3OH(g)+H2O(g) ,右下图表示该反应进行过程中能量(单位为kJ?mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是___________。
参考答案:(1)①温度(2分) ②bc(2分)
(2)① 0.16mol·L-1·min-1 (2分) ②吸(2分)
(3)cd(2分)
本题解析:略
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学试题《影响化学反应速率.. | |