微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 已知D、H是常见的非金属单质,其中H是黄绿色气体.J是一种金属单质,J元素的+2价化合物比+4价化合物稳定.D、J元素在周期表中同主族,D是形成化合物种类最多的元素.A、C是金属氧化物,C和J均是某种常见电池的电极材料,B与C反应时,每生成1mol?H同时消耗4mol?B和1mol?C.它们之间的关系如图:
(1)写出物质A的化学式______.
(2)写出反应②的化学方程式______.
(3)由金属氧化物A和C得到其相应的金属单质,在冶金工业上一般可用______方法(填序号).
①热分解法?②热还原法?③电解法
其中从A得到其相应金属也可以用铝热法,若反应中lmolA参加反应,转移电子的物质的量为______mol.
(4)用C、J作电极,与硫酸构成如图所示电池,工作时电池发生的总反应式为______,当反应转移1mol电子时,溶液中消耗H+的物质的量为______mol.
(5)向框图中的红褐色透明液体K中逐滴滴入HCl溶液.可以观察到先产生红褐色沉淀,后红褐色沉淀溶解,请解释原因______
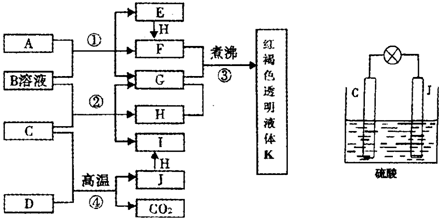
参考答案:H是黄绿色气体,为Cl2,D是形成化合物种类最多的元素,所以D是碳,D、J元素在周期表中同主族,J是一种金属单质,J元素的+2价化合物比+4价化合物稳定,所以J是Pb,C+D→Pb+CO2,C是金属氧化物,所以C是PbO,PbO+B→Cl2+G+I,B与C反应时,每生成1mol?H同时消耗4mol?B和1mol?C,根据得失电子守恒知,B是HCl,A是金属氧化物,A+盐酸→E+F+G,E和氯气反应生成F,所以A中金属元素是变价元素,为铁元素,A是四氧化三铁,E是氯化亚铁,F是氯化铁,G是水,I是PbCl2,氯化铁溶液煮沸得氢氧化铁胶体K.
(1)通过以上分析知,A是Fe3O4,故答案为:Fe3O4;
(2)二氧化铅和盐酸反应生成氯化铅、氯气和水,反应方程式为:PbO2+4HCl=PbCl2+Cl2↑+2H2O,
故答案为:PbO2+4HCl=PbCl2+Cl2↑+2H2O
(3)铁和铅属于较活泼金属,采用热还原法冶炼,故选②;
设转移电子的物质的量是x.
3Fe3O4+8Al?高温?.?9Fe+4Al2O3转移电子
3mol? 24mol
1mol?x
x=8mol
故答案为:②;8;
(4)用C、J作电极,与硫酸构成的原电池中,铅失电子,二氧化铅得电子,与硫酸反应生成硫酸铅和水,反应方程式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,
设消耗硫酸的物质的量是y.
Pb+PbO2+2H2SO4=2PbSO4+2H2O转移电子
? 2mol? 2mol
? y? 1mol
y=1mol,1mol硫酸中氢离子的物质的量是2mol,
故答案为:Pb+PbO2+2H2SO4=2PbSO4+2H2O;2;
(5)向胶体中滴加电解质溶液会产生聚沉现象,氢氧化铁又能和盐酸反应生成可溶性盐,所以沉淀会溶解,
故答案为:开始加盐酸时,氢氧化铁胶体遇电解质发生聚沉,再继续滴加则氢氧化铁沉淀与盐酸发生酸碱中和反应,沉淀溶解.
本题解析:
本题难度:一般
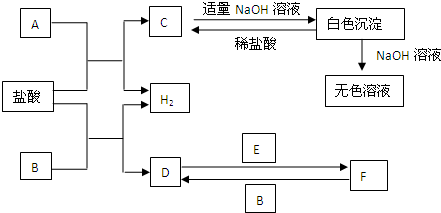
2、简答题 下列物质A~F是我们熟悉的单质或化合物,其中A、B均是常见的金属,且B的合金用量最大;E在常温下是黄绿色气体;在适当的条件下,它们之间可以发生如图所示的转化.
试回答下列问题:
(1)白色沉淀与NaOH溶液反应的离子方程式是______;
(2)反应F→D的化学方程式是______;
(3)检验F中金属阳离子的常用方法是______;
(4)E与石灰乳反应的化学方程式是______.
参考答案:B是常见的金属,且B的合金用量最大,B为Fe,由B+盐酸→D+H2可知,D为FeCl2,E在常温下是黄绿色气体,E为Cl2,FeCl2与Cl2反应生成FeCl3,F为FeCl3,FeCl3溶液可以与Fe反应生成FeCl2,符合转化关系;
A是常见的金属,由A+盐酸→C+H2,C为金属氯化物,C与氢氧化钠反应生成白色沉淀,可以溶于氢氧化钠、盐酸,故该白色沉淀为Al(OH)3,故C为AlCl3,A为Al,
(1)白色沉淀是氢氧化铝,氢氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水,离子方程式为Al(OH)3+OH-═AlO2-+2H2O,故答案为:Al(OH)3+OH-═AlO2-+2H2O;
(2)反应F→D是FeCl3生成FeCl2的反应,反应的化学方程式是:2FeCl3+Fe=3FeCl2,故答案为:2FeCl3+Fe=3FeCl2;
(3)检验F中金属阳离子是Fe3+,检验的常用方法是:取溶于少许于试管中,加入KSCN溶液,溶液变为血红色溶液,证明是三价铁离子的存在,故答案为:加入KSCN溶液,溶液呈血红色则含Fe3+;
(4)氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,反应方程式为2Cl2+Ca(OH)2=CaCl2+Ca(ClO)2+H2O,故答案为:2Cl2+Ca(OH)2=CaCl2+Ca(ClO)2+H2O.
本题解析:
本题难度:简单
3、推断题 已知有以下物质相互转化

试回答:
(1)写出B的化学式? ,D的化学式? ?。
(2)写出由E转变成F的化学方程式? ? ?。
(3)写出用KSCN鉴别G溶液的离子方程式? ? ;
向G溶液加入A的有关离子反应方程式? 。
参考答案:(1)FeCl2;KCl
(2)4F来源:91考试网 91exam.orge(OH)2+O2+2H2O===4Fe(OH)3
?(3)Fe3++SCN-===Fe(SCN)2+;2Fe3++Fe===3Fe2+
本题解析:
本题难度:一般
4、填空题 (10分) A、B、C、D四种元素都是短周期元素。A元素的离子具有黄色的焰色反应。B元素的离子结构和Ne具有相同的电子层排布;5.8gB的氢氧化物恰好能与100ml 2mol/L盐酸完全反应;B原子核中质子数和中子数相等。H2在C单质中燃烧产生苍白色火焰。D元素原子的电子层结构最外层电子数是次外层电子数的三倍。根据上述条件,回答:
(1)元素C位于第_____周期第_____族,它的最高价氧化物的化学式为_____?_。?
(2)A是元素______?___,B是元素______?___,D是元素_______?_____。
(3)A与D形成稳定化合物的化学式为_____________,判断该化合物在空气是否变质的简易方法是______?_________。
(4)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液来吸收,其离子方程式为_____________?______________。?
参考答案:(1)3;ⅦA;Cl2O7。(2)Na;Mg;O。
(3)Na2O2;观察该化合物的颜色是否变白。(4)Cl2+2OH—=Cl—+ClO—+H2O
本题解析:根据元素的结构及有关性质可知, A、B、C、D四种元素分步是Na、Mg、Cl、O。
(1)氯元素的原子序数是17,所以位于第三周期第ⅦA;氯元素的最高价是+7价,所以最高价氧化物是Cl2O7。
(2)略
(3)钠和氧形成的稳定化合物是过氧化钠,化学式为Na2O2;过氧化钠是淡黄色的,变质后变成白色,据此可以鉴别,即观察该化合物的颜色是否变白。
(4)氯气有毒,可用氢氧化钠溶液吸收,方程式为Cl2+2OH—=Cl—+ClO—+H2O。
本题难度:一般
5、选择题 由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如 右图转化关系(部分生成物和反应条件略去)。下列推断不正确的是
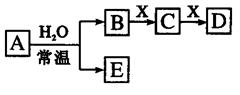
A.若X是Na2CO3,C为CO2,则A一定是氯气,且D和E不反应
B.若A是单质,B和D的反应是OH-+HCO3- =H2O+ CO32-,则E一定能还原Fe2O3
C.若D为CO,C能和E反应,则A一定为Na2O2
D.若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
参考答案:A
本题解析:试题分析:若X是Na2CO3,C为CO2,则B为HCl,D为NaHCO3,A为Cl2,E为HClO,D与E可以发生反应,生成NaClO.因此,选项A说法错误。故答案选A。
考点:物质的性质
点评:本题以选择题的形式考查了物质的性质,属于综合性较强的题目。解题的关键在于熟练掌握相关物质的性质,属于中档题。
本题难度:简单