微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 往一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g)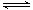 2HI(g);(正反应放热),当达到平衡后,t0时改变反应的某一条件(混合气体总物质的量不变),且造成容器内压强增大,下列说法正确的是(?)
2HI(g);(正反应放热),当达到平衡后,t0时改变反应的某一条件(混合气体总物质的量不变),且造成容器内压强增大,下列说法正确的是(?)
A.容器内气体颜色变深,平均相对分子质量变小
B.平衡不移动,混合气体密度增大
C.改变条件前后,速度图象为(如下图)
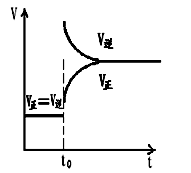
D.H2转化率增大,HI平衡浓度变小
参考答案:C
本题解析:依照题目要求,t0时改变的反应条件为升温:混合气体的总量不变,但压强增大,平衡向吸热方向移动,即左移,逆反应速率大于正反应速率,故C正确;氢气的转化率减小,HI的平衡浓度减小,排除D
平衡左移,碘蒸气浓度增大,容器内气体颜色加深,但总气体的质量、物质的量不变,所以混合气体的密度、平均分子质量不变,排除AB;
故答案为C
本题难度:简单
2、选择题 已知常温常压和催化剂条件下,N2(g)和H2(g)生成2 mol NH3(g)放出92.4 kJ的热量。在上述条件下向密闭容器中通入1 mol N2和3 mol H2,达到平衡时放出热量为Q1 kJ;向另一体积相同的容器中通入0.9 mol N2、2.7 mol H2和0.2 mol NH3,相同条件下达到平衡时放出热量为Q2 kJ。则下列关系式正确的是(? )
A.2Q=Q1="92.4"
B.Q2<Q1<92.4
C.Q1<Q2<92.4
D.Q1=Q2=92.4
参考答案:B
本题解析:根据题意,每生成2 mol NH3放出92.4 kJ热量,1 mol N2和3 mol H2反应,达到平衡态,生成NH3小于2 mol,故放出热量小于92.4 kJ;另一容器中通入0.9 mol N2、2.7 mol H2和0.2 mol NH3,相同条件下达到平衡时与上述平衡是等效平衡,但由于充入了NH3,所以N2和H2反应生成的NH3比上述平衡少,故有Q2<Q1<92.4。
本题难度:简单
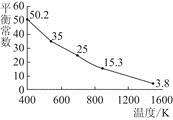
3、选择题 碘单质难溶于水却易溶于KI溶液。碘水中加入KI溶液发生反应:I2(aq)+I-(aq)  I(aq),该反应的平衡常数与温度的关系如图,下列说法不正确的是(? )
I(aq),该反应的平衡常数与温度的关系如图,下列说法不正确的是(? )
A.上述正反应为放热反应
B.上述体系中加入苯,平衡不移动
C.可运用该反应原理除去硫粉中少量的碘单质
D.实验室配制碘水时,为增大碘单质的溶解度可加入适量KI溶液
参考答案:B
本题解析:由温度越高,化学平衡常数越小,可知该反应为放热反应,A项正确;在该体系中加入苯,苯萃取了I2,平衡向逆反应方向移动,B项错误。
本题难度:一般
4、填空题 (7分)某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。
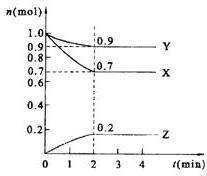
①由图中所给数据进行分析,该反应的化学方程式为?;
②?反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=?,
③当反应进行了3 min,该反应是否达到平衡?(填“是”或“否”)。
(2)把除去氧化膜的镁条投入到盛有稀盐酸的试管中,发现H2生成的速率变化情况如图,其中
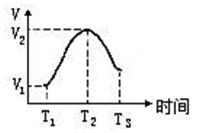
T1~T2速率变化的主要原因是__?__,?
T2~T3速率变化的主要原因是___? ___?
参考答案:(1)①3X+Y 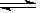 ?2Z?② 0.05mol/(l.min) ③是
?2Z?② 0.05mol/(l.min) ③是
(2)反应放热,溶液温度升高,反应速率增大;?溶液中H+的浓度逐渐减小,反应速率减小
本题解析:略
本题难度:一般
5、填空题 (6分)在一个容积不变的反应容器中,可以通过调节温度使下列反应:A(g)+2B(g)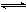 2C(g) 达到平衡时保持容器内气体的总物质的量为15 mol。现向反应容器中加6.5 mol A、X mol B、4 mol C。
2C(g) 达到平衡时保持容器内气体的总物质的量为15 mol。现向反应容器中加6.5 mol A、X mol B、4 mol C。
(1)若X=5.5时需要降低体系温度才能使反应达平衡时符合题设条件,则正反应为_________反应。(填“吸热”或“放热”)
(2)欲使该反应起始时维持逆向移动,则X的取值范围_________________________。
参考答案:(每空3分)(1)放热;(2)(2.5,4.5)
本题解析:略
本题难度:一般