|
高中化学必备知识点《物质组成与性质实验方案的设计》高频考点强化练习(2017年最新版)(十)
2017-07-18 01:53:12
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 苯和溴的取代反应的实验装置如图所示,其中A为带支管口的试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑粉。
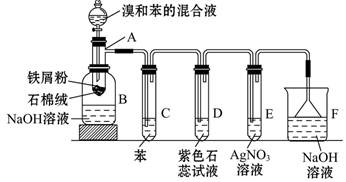
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式):_______________________。
(2)试管C中苯的作用是__________。反应开始后,观察D和E两试管,看到的现象为________。
(3)反应2~3 min后,在B中可观察到的现象是_________。利用这种方法得到的粗溴苯中还含有的杂质主要是?,需进一步提纯,下列操作中必须的是?(填正确答案前的字母)
A.蒸馏
B.重结晶
C.过滤
D.萃取
| (4)该实验除①步骤简单,操作方便,成功率高;②各步现象明显;③对产品便于观察这三个优点外,还有一个优点是_____________。
参考答案:(12分) (1)
(2)除去HBr气体中混有的溴蒸气? D试管中石蕊试液慢慢变红,并在导管口有白雾产生,然后E试管中出现浅黄色沉淀? (3)在溶液底部有无色油状液体?苯? A
(4)充分吸收有毒气体,防止污染环境
本题解析:(1)在催化剂的作用下,苯环上的氢原子被溴原子所取代,生成溴苯,同时有溴化氢生成:C6H6+Br2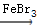 ?C6H5Br+HBr, ?C6H5Br+HBr,
故答案为:C6H6+Br2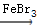 C6H5Br+HBr; C6H5Br+HBr;
(2)苯和液溴反应生成溴苯和溴化氢,溴化氢的溶液呈酸性,与紫色的石蕊试剂显红色,溴化氢与硝酸银反应生成浅黄色的溴化银和硝酸,且溴化银不溶于硝酸,
故答案为:除去HBr气体中混有的溴蒸气? D试管中石蕊试液慢慢变红,并在导管口有白雾产生,然后E试管中出现浅黄色沉淀;
(3)溴苯是有机物,氢氧化钠溶液是无机物,所以溴苯和氢氧化钠溶液不互溶,且溴苯的密度大于水的密度,所以在B中的氢氧化钠溶液里可观察到的现象是底层出现油状液体。
故答案为:在溶液底部有无色油状液体?苯? A。
(4)溴化氢溶于水能得到氢溴酸,溴和水反应也可得到氢溴酸,如果没有C装置,无法判断该反应中是否有溴化氢生成;苯溶解了溴,除去的溴的干扰,所以能判断该反应有溴化氢生成,故答案为:充分吸收有毒气体,防止污染环境。
点评:本题考查了苯的取代反应实验,考查的知识点有反应方程式的书写、产物的判断、蒸汽的成分及性质,综合性较强,难度较大,注意苯能和液溴发生取代反应,和溴水不反应。
本题难度:一般
2、实验题 某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表。请从下表中实验现象(II)(填A、B、C……)中选出与实验方案(I)(填1、2、3……)对应的实验现象,填入答案(III)中。
实验方案(I)
| 实验现象(II)
| 答案(III)
| I
| II
| 1.用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞
| A.浮与水面,剧烈反应,放出气体,熔成一个小球,在水面上无定向移动,随之消失,溶液变红色。
| 1
| ?
| 2.向新制的H2S饱和溶液中滴加新制的氯水
| B.产生大量气体,可在空气中燃烧,溶液变成浅红色
| 2
| ?
| 3.钠与滴有酚酞的冷水反应
| C.反应不十分剧烈,产生的气体可以在空气中燃烧
| 3
| ?
| 4.镁带与2mol/L的盐酸反应
| D.剧烈反应,产生的气体可以在空气中燃烧
| 4
| ?
| 5.铝条与2mol/L的盐酸反应
| E.生成白色絮状沉淀,继而沉淀消失
| 5
| ?
| 6.向AlCl3溶液中滴加NaOH溶液至过量
| F.生成淡黄色沉淀
| 6
|
|
通过以上实验分析了同周期的哪些元素(填元素符号)________________,从实验结果可以得出的结论是______________________________________。
参考答案:
答案(III)
I
II
1
B
2
F
3
A
4
D
5
C
6
E
Na、Mg、Al、S、Cl? (错误元素符号超过3个0分,其余不全的1分,全对2分)?
同一周期,随着原子序数的递增,元素的金属性减弱,非金属性增强。(2分)
本题解析:上述罗列了一些对比实验,显然是为了探究元素的递变规律。A中溶液变红色,是因为生成碱性的NaOH;B、C、D中可燃烧的气体为H2;E中白色絮状沉淀为氢氧化铝;F中淡黄色沉淀是S单质。
点评:对化学实验的考查是历年的高考重点,考生在备考中应注意对化学仪器的使用、化学实验现象、实验安全、常见物质的制备及收集等的相关知识的积累。难度较大。
本题难度:一般
3、实验题 某化学小组为测定加碘盐中KIO3的质量分数,进行了如下实验。
已知:KIO3 + 5KI + 3H2SO4= 3K2SO4 + 3I2 + 3H2O
I2 + 2Na2S2O3 = Na2S4O6 + 2NaI
步骤一:准确称取a g加碘盐,配制成250mL溶液;
步骤二:取所配制溶液25.00mL于锥形瓶中,加稀硫酸酸化,再加入足量的KI溶液;
步骤三:用bmol·L-1 Na2S2O3溶液的溶液滴定步骤二所得溶液至终点,记录数据;再重复滴定2次,平均消耗Na2S2O3溶液的体积为12.00mL。
(1)步骤一中配制250mL溶液,所用到的玻璃仪器除烧杯、玻璃棒和胶头滴管外,还有?。
(2)步骤三中进行滴定的过程中下列哪个操作正确?,

选择?作为指示剂,到达滴定终点时的现象为?。
(3)实验测得此加碘盐中KIO3的质量分数=?(KIO3的相对分子质量为214)。
参考答案:
(1)250mL容量瓶
(2)B?淀粉?
当滴入最后一或半滴Na2S2O3溶液时,溶液的蓝色褪去,且半分钟内溶液不恢复蓝色。
(3)(4.28b)/a × 100%
本题解析:(1)配制250mL溶液用到的仪器有托盘天平、药匙、玻璃棒、烧杯、250mL容量瓶、量筒(可用可不用),故还需要的玻璃仪器有:250mL容量瓶,故答案为:250mL容量瓶;
(2)硫代硫酸钠显碱性,应使用碱式滴定管,因此选B。硫代硫酸钠遇到碘单质被碘氧化,可以使碘变成碘离子,因此使用淀粉作指示剂。到达滴下终点时的现象为:当滴入最后一或半滴Na2S2O3溶液时,溶液的蓝色褪去,且半分钟内溶液不恢复蓝色。
(3)25mL溶液消耗Na2S2O3的物质的量为b?mol?L-1×0.012L=0.012mol,故250mL溶液应消耗Na2S2O3的物质的量为0.012bmol×10=0.12bmol,令250mL溶液中KIO3的物质的量为xmol,则:
KIO3~~~~3I2~~~~6Na2S2O3
1? 6
xmol?0.12bmol
所以x=0.02b
故加碘盐中KIO3的质量分数: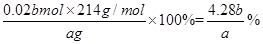
本题难度:一般
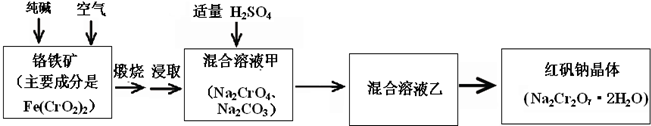
4、简答题 重铬酸钠俗称红矾钠(Na2Cr2O7?2H2O)是重要的化工产品和强氧化剂.工业制备的流程如下:
请回答:
(1)已知Fe(CrO2)2中铬元素是+3价,则Fe(CrO2)2中铁元素是______价.
(2)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O?SiO2,则Fe(CrO2)2可写成______.
(3)煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2生成可溶于水的Na2CrO4,反应化学方程式如下:
4Fe(CrO2)2+8Na2CO3+7O2=2Fe2O3+8Na2CO4+8CO2
为了加快该反应的反应速率,可采取的措施是______.
(4)已知CrO42-在不同的酸性溶液中有不同的反应,如:
2CrO42-+2H+=Cr2O72-+H2O;
3CrO42-+4H+=Cr3O102-+2H2O
①往混合溶液甲中加入硫酸必须适量的原因是______.
②混合溶液乙中溶质的化学式是______.
(5)+3、+6价铬都有很强的毒性,+6价铬的毒性更高,可诱发肺癌和鼻咽癌,所以制取红矾钠后的废水中含有的Cr2O72-必须除去.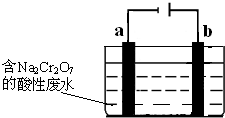
工业上可用电解法来处理含Cr2O72-的废水,如图为电解装置示意图(电极材料分别为铁和石墨).通电后,Cr2O72-在b极附近转变为Cr3+,一段时间后Cr3+最终可在a极附近变成Cr(OH)3沉淀而被除去.
a电极的电极反应式是______,b电极附近反应的离子方程式是______.
参考答案:(1)Fe(CrO2)2中,氧元素的化合价是-2价,总的负价是-8价,铬元素的化合价是+3价,2个铬原子化合价是+6价,所以铁元素化合价是+2价,
故答案为:+2
(2)Fe(CrO2)2 中铁元素化合价是+2价,氧化物为FeO,铬元素化合价+3价,氧化物为Cr2O3,所以Fe(CrO2)2写成氧化物形式为FeO?Cr2O3,
故答案为:FeO?Cr2O3 ;
(3)增大反应物接触面积可以加快反应速率,升高温度可以大大加快反应速率,
故答案为:粉碎矿石、升高温度;
(4)①由于少量难以除尽碳酸钠,过量会发生反应3CrO42-+4H+=Cr3O102-+2H2O,生成了Na2Cr3O10等副产物,所以必须加入适量硫酸,
故答案为:少量不能除尽Na2CO3等杂质,过量会生成Na2Cr3O10等副产物;
②由于发生了反应2CrO42-+2H+=Cr2O72-+H2O,生成了Na2Cr2O7和Na2SO4,所以乙中溶质的化学式Na2Cr2O7和Na2SO4,
故答案为:Na2Cr2O7和Na2SO4;
(5)根据电解槽图示可知,a为阴极,溶液显示酸性,溶液中氢离子得到电子,发生还原反应,电极反应为:2H++2e-=H2↑,
b为阳极,铁失去电子生成亚铁离子,亚铁离子被Cr2O72-氧化成铁离子,反应的方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,
故答案为:2H++2e-=H2↑,Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O.
本题解析:
本题难度:一般
5、实验题 工业上将纯净干燥的氯气通入到0.375 mol/L NaOH溶液中得到漂白水。某同学想在实验室探究Cl2的性质并模拟制备漂白水,下图是部分实验装置。已知KMnO4与盐酸反应可以制取Cl2。
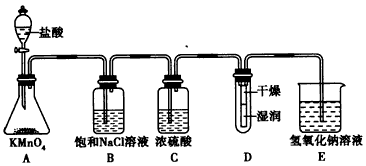
(1)配制物质的量浓度为0.375 mol/L NaOH溶液时,用托盘天平称取所需的NaOH质量为__________。
(2)浓硫酸的作用是______________________。
(3)装置E中发生化学反应方程式为______________________________。
(4)装置B中饱和NaCl溶液的作用是_______________。
(5)实验时装置D中湿润的部分红色纸条褪色,干燥部分没有褪色,放置一段时间后,纸条全部褪色。该同学认为Cl2的密度比空气大,可能是试管下部Cl2的浓度大于试管上部Cl2的浓度所导致的。请判断该解释是否合理,并分析产生上述实验现象的原因;如需改进,请简述设计方案(若认为合理,则此问可不作答)___________________。
(6)氯元素含量为10%的漂白水溶液355 g,其中含NaClO的物质的量为___________mol。
参考答案:(1)1.5 g
(2)干燥氯气
(3)Cl2 + 2NaOH = NaCl + NaClO + H2O
(4)除去Cl2中的HCl气体
(5)不合理;实验进行中Cl2与湿润的红色纸条中的水反应生成HClO使湿润的红色纸条褪色,干燥部分没有HClO,所以纸条不褪色,放置一段时间,由于水分子的运动会导致整个纸条湿润而褪色,取一塑料板将干燥的红色纸条和湿润的红色纸条分别贴在塑料板两侧,将该装置放入装置D中。或将氯气先通入装有干燥的红色纸条的试管,再通入装有湿润的红色纸条的试管中
(6)0.5
本题解析:
本题难度:一般
|