微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)KMnO4是一种用途广泛的氧化剂,可由软锰矿(主要成分为MnO2)通过下列方法制备:①软锰矿与过量KOH、KC1O3固体熔融生成K2MnO4;②溶解、过滤后将滤液酸化,使K2MnO4完全转变为MnO2和KMnO4;③滤去MnO2,将滤液浓缩、结晶得深紫色的KMnO4产品。
(1)制备过程中,为了提高原料的利用率,可采取的措施是?。
(2)滤液酸化时,K2MnO4转变为MnO2和KMnO4的离子方程式是?。
(3)测定KMnO4产品的纯度可用标准Na2S2O3溶液进行滴定
①配制250mL0.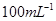 ?标准Na2S2O3溶液,需准确称取Na2S2O3固体的质量
?标准Na2S2O3溶液,需准确称取Na2S2O3固体的质量
? g.
②取上述制得的KMnO4产品0.316g,酸化后用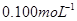 标准Na2S2O3溶液进行滴定,滴定至终点消耗Na2S2O3溶液12.00mL。计算该KMnO4产品的纯度。(有关离子方程式为:
标准Na2S2O3溶液进行滴定,滴定至终点消耗Na2S2O3溶液12.00mL。计算该KMnO4产品的纯度。(有关离子方程式为: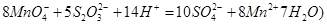
参考答案:(1)将③中MnO2回收利用(2分)
(2)3MnO42-+4H+=MnO2↓+2MnO4-+2H2O(2分)
(3)①3.95(3分)
② 8KMnO4~ 5S2O32-
8×158 g? 5 mol
0.316 g×w 0.100 mol·L-1×12.00 mL×10-3 L·mL-1
w =96%(或0.96)(5分)
本题解析:(1)制备过程中,为了提高原料的利用率,一般是原料的循环使用,即可以将将③中MnO2回收利用。
(2)根据反应物和生成物可知,反应的方程式为3MnO42-+4H+=MnO2↓+2MnO4-+2H2O。
(3)①250mL0.100mol/L 标准Na2S2O3溶液中,溶质的物质的量是0.025mol,质量是0.025mol×158g/mol=3.95g。
②本题可以通过关系式计算。
本题难度:一般
2、实验题 (18分)某同学欲配制450mL 0.1mol/L的碳酸钠溶液,试根据所学回答下列问题。
(1)若采用5mol/L的碳酸钠溶液配制溶液,需要用到碳酸钠溶液的体积为?。
(2)若用碳酸钠固体配制,一定会用到的仪器有________________________
A.450ml容量瓶? B.500 ml容量瓶? C.量筒? D.胶头滴管
E.烧杯? F.玻璃棒? G.托盘天平
(3)欲准确配制所需溶液,下列称量质量正确的是?(?)
A.称Na2CO3? 4.8克? B.Na2CO3 5.3克
C.称Na2CO3·10H2O? 12.87克? D.称Na2CO3·10H2O 14.30克
(4)若在配溶液的过程中用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,处理的方法是________(填序号)。
A.吸出多余液体,使凹液面与刻度线相切
B.小心加热容量瓶,经蒸发后,使凹液面与刻度线相切
C.经计算加入一定量的碳酸钠固体
D.重新配制
(5)下列操作可能导致结果偏高的是?。
A.转移后没有洗涤烧杯
B.定容时俯视
C.定容时仰视
D.称取的Na2CO3溶液中混有少量Na2CO3·10H2O
E.配溶液前用碳酸钠溶液润洗容量瓶
参考答案:(1)0.01L或10ml 3分?(2)BDEFG? 5分
(3) B 3分?(4)D 3分?(5) BE? 4分
本题解析:略
本题难度:简单
3、填空题 (20分)
某芳香族化合物A的分子中含有C、H、O、N四种元素,相同状况下,其蒸气的密度氢气密度的68.5倍。现以苯为原料合成A,并最终制得F(一种染料中间体),转化关系如下:(一些非主要产物已略去)
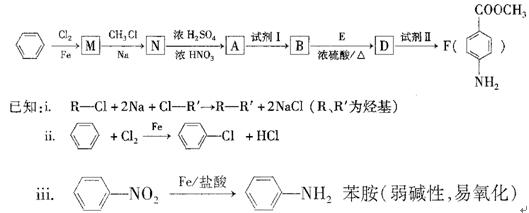
请回答下列问题:
(1)写出A的分子式?;A的结构简式?。
(2)N—A的反应类型是?。
(3)①上述转化中试剂I和试剂Ⅱ分别是:试剂I?;试剂Ⅱ?(选填字母)。
a.KMnO4(H+)? b.Fe/盐酸? c.NaOH溶液
②若上述转化中物质A依次与试剂II、试剂I、化合物E(浓硫酸/△)作用,能否得到F,为什么??。
(4)用核磁共振氢谱可以证明化合物E中含有?种处于不同化学环境的氢。
(5)写出同时 符合下列要求的两种D的同分异构体的结构简式一。
符合下列要求的两种D的同分异构体的结构简式一。
①属于芳香族化合物,分子中有两个:互为对位的取代基,其中一个取代基是硝基;
②分子中含有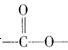 结构。
结构。
(6)有一种D的同分异构体W,在酸性条件下水解后,可得到一种能与FeCl,溶液发生显色反应的产物,写出W在酸性条件下水解的化学方程式
(7)F的水解反应如下:
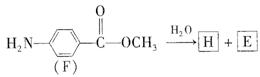
化合物H在一定条件下经缩聚反应可制得高分子纤维,广泛用于通讯、导弹、宇航等领域。请写出该缩聚反应的化学方程式?。
参考答案:
(1)C7H7NO2? …………2分
 ? …………2分
? …………2分
(2)取代反应? …………2分
(3)①a? …………1分
b? …………1分
②不可以,(1分)若先还原后氧化,则还原生成的氨基又会被氧化
…………1分
(4)2? …………2分
(5)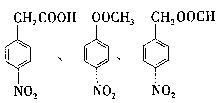 ……(每个2分,共4分,写出两个即可)
……(每个2分,共4分,写出两个即可)
(6) …2分
…2分
(7)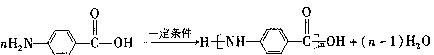 ……2分
……2分
(方程式不写条件或写“ ” 不扣分)
” 不扣分)
本题解析:略
本题难度:一般
4、简答题 (14分)硫代硫酸钠(Na2S2O3)俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等。实验室可通过如下反应制取:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。
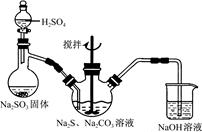 ?
?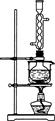
图1?图2
(1)用图1所示装置制取Na2S2O3,其中NaOH溶液的作用是_____________________。
如将分液漏斗中的H2SO4改成浓盐酸,则三颈烧瓶内除Na2S2O3生成外,还有?
(填化学式)杂质生成。
(2)为测定所得保险粉样品中Na2S2O3·5H2O的质量分数,可用标准碘溶液进行滴定,
该反应的化学方程式为:2Na2S2O3+I2 = 2NaI+Na2S4O6
①利用KIO3、KI和HCl作原料可配制标准碘溶液。写出配制时所发生反应的离子方程式?。
②准确称取一定质量的Na2S2O3·5H2O样品于锥形瓶中,加水溶解,并滴加______作指示剂,用所配制的标准碘溶液滴定。滴定时所用的玻璃仪器除锥形瓶外,还有?。
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果___________(填“偏高”“偏低”或“不变”)。
(3)本实验对Na2S的纯度要求较高,利用图2所示的装置可将工业级的Na2S提纯。已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。
提纯步骤依次为:
①将已称量好的工业级Na2S放入圆底烧瓶中,并加入一定质量的酒精和少量水;
②按图2所示装配所需仪器,向冷凝管中通入冷却水,水浴加热;
③待?时,停止加热,将烧瓶取下;
④ __________________________;
⑤ __________________________;
⑥将所得固体洗涤、干燥,即可得到Na2S·9H2O晶体。
参考答案:(14分)(1)吸收二氧化硫等尾气,防止污染空气 (2分)? NaCl(2分)
(2)①IO3-+5I-+6 H+=3I2+ 3H2O(2分)
②淀粉溶液?(2分)?酸式滴定管(2分)
③偏低(1分)
(3)③烧瓶中固体不再减少(1分)
④趁热过滤(1分)
⑤将所得滤液冷却结晶,过滤(1分)
本题解析:(1)图1所示装置中有二氧化硫参与反应,所以氢氧化钠的作用是吸收二氧化硫等尾气,防止污染空气;如将分液漏斗中的H2SO4改成浓盐酸,浓盐酸易挥发,与三颈烧瓶内的物质反应生成NaCl,所以三颈烧瓶内除Na2S2O3生成外,还有NaCl杂质生成;
(2)①KIO3、KI和HCl作原料可配制标准碘溶液,说明产物中有单质碘生成,所以化学方程式的元素守恒规律可写出该反应的离子方程式为IO3-+5I-+6 H+=3I2+ 3H2O;
②因为碘遇淀粉变蓝色,所以选择淀粉作指示剂;滴定时Na2S2O3·5H2O样品溶液放于锥形瓶中,则标准碘溶液应放在酸式滴定管中;不能用碱式滴定管盛放碘溶液,因为碘单质有一定的氧化性,容易腐蚀碱式滴定管的胶管部分;
③滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则所用标准碘液偏少,造成Na2S2O3·5H2O的质量分数偏低;
(3)③根据Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精的特点,判断待烧瓶中固体不再减少时停止加热;
④杂质不溶于酒精,所以趁热过滤可除去杂质;
⑤Na2S在低温时在酒精中的溶解度减小,所以将过滤后的滤液冷却结晶,再过滤可得晶体样品。
本题难度:一般
5、填空题 (16分)某同学拟用粗氧化铜(含少量氧化亚铁及不溶于酸的杂质)制取无水氯化铜,流程如图所示:
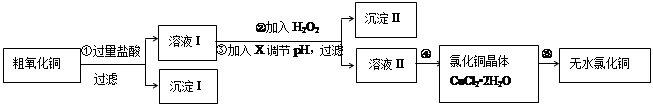
(1)步骤①中涉及的离子方程式有:?。
(2)步骤②中加入H2O2的目的是:??反应的离子方程式为?。
(3)已知:
| 氢氧化物开始沉淀时的pH
| 氢氧化物沉淀完全时的pH
|
Fe3+
| 1.9
| 3.2
|
Cu2+
| 4.7
| 6.7
|
Fe2+
| 7
| 9
|
步骤③中调节pH的最佳范围为?,
步骤③中可以用于调节溶液pH的试剂X是?:
a.Cu2(OH)2CO3? b.CuO? c.? Cu(OH)2? d.NH3?H2O
(4)步骤④进行的操作是?,过滤、洗涤、干燥。?在步骤⑤中要得到无水CuCl2,需要在?加热CuCl2·2H2O。
参考答案:(16分)(1)CuO+2H+=Cu2++H2O(2分),FeO+2H+=Fe2++H2O(2分);
(2)将Fe2+氧化成Fe3+(2分), 2Fe2++H2O2+2H+=2Fe3++2H2O(2分);
(3)3.2至4.7(2分);? a b c (2分);
(4)蒸发浓缩,冷却结晶(2分)。干燥的HCl气流中(2分)
本题解析:】(1)氧化铜是碱性氧化物,和盐酸反应的离子方程式为CuO+2H+=Cu2++H2O。
(2)由于溶液中含有亚铁离子,而亚铁离子的沉淀pH大于铜离子的,所以应该把亚铁离子转化为铁离子而产生氢氧化铁沉淀,从而除去杂质。
(3)要沉淀铁离子而保留铜离子,则根据pH可知,应该是3.2至4.7之间。由于调节pH是不能引入杂质的,所以答案选bc。
(4)要得到氯化铜晶体,则应该是蒸发浓缩,冷却结晶,然后过滤、洗涤干燥即可。氯化铜是强酸弱碱盐,水解生成氢氧化铜和氯化氢。所以在加热过程中,应该在氯化物的气流中进行以防止CuCl2发生水解。
本题难度:一般