微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关说法正确的是( )
A.铁红可用作红色涂料
B.小苏打可用于治疗胃酸过多
C.铁是地壳中含量最多的金属元素
D.高压钠灯透雾性强,可用于公路两旁的照明灯
参考答案:AD
本题解析:
本题难度:一般
2、实验题 (12分)硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过如下实验由废铁屑制备FeSO4·7H2O晶体:
①将5% Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2~3遍;②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80 ℃之间至铁屑耗尽;③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请完成下列问题:
(1)实验步骤①的目的是___________________,加热的作用是
_________________________。
(2)实验步骤②明显不合理,理由是
________________________________________________。
(3)实验步骤④中用少量冰水洗涤晶体,其目的是_________________;
__________________。
(4)经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4·7H2O、FeSO4·4H2O和FeSO4·H2O。硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示(仅在56.7 ℃、64 ℃温度下可同时析出两种晶体)。
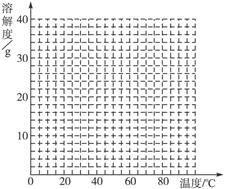
硫酸亚铁的溶解度和析出晶体的组成
温度/℃
| 0
| 10
| 30
| 50
| 56.7
| 60
| 64
| 70
| 80
| 90
|
溶解度/g
| 14.0
| 17.0
| 25.0
| 33.0
| 35.2
| 35.3
| 35.6
| 33.0
| 30.5
| 27.0
|
析出晶体
| FeSO4·7H2O
| FeSO4·4H2O
| FeSO4·H2O
|
请根据表中数据作出硫酸亚铁的溶解度曲线。
(5)若需从硫酸亚铁溶液中结晶出FeSO4·4H2O,应控制的结晶温度(t)的范围为________。
参考答案:(1)除油污?升高温度,溶液碱性增强,去油污能力增强
(2)应该铁屑过量(或反应后溶液中必须有铁剩余),否则溶液中可能有Fe3+存在
(3)洗涤除去晶体表面附着的硫酸等杂质
用冰水洗涤可降低洗涤过程中FeSO4·7H2O的损耗
(4)如图
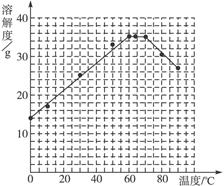
(5)56.7 ℃<t<64 ℃
本题解析:(1)Na2CO3溶液的主要作用是除去废铁屑表面的油污,因为升高温度,Na2CO3的水解程度大,去污能力强,故需加热。
(2)Fe2+易被空气中的O2氧化成Fe3+,要保证得到较纯净的FeSO4·7H2O晶体,必须在溶解铁屑时保证铁屑过量。
(3)要得到纯净的FeSO4·7H2O晶体,在滤出晶体后必须洗涤2~3次,以除去其表面的杂质离子。
本题难度:简单
3、简答题 生活中常使用的铝合金中的铝来自于电解熔融氧化铝.用于工业电解的氧化铝要求其纯度不得低于98.2%,而天然铝土矿中的氧化铝含量为50%~70%,杂质主要为SiO2、Fe2O3、CaO、MgO、Na2O等.工业生产铝锭的工艺流程示意图如下所示:
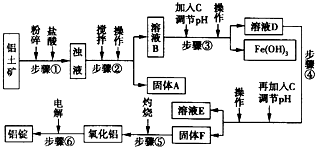
一些难溶物开始沉淀和完全沉淀的pH如表所示:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2
开始沉淀pH(离子初始浓度为0.01mol、L)
4
2.3
10.4
完全沉淀pH(离子浓度<10-5mol/L)
5.2
4.1
12.4
|
请回答下列问题:
(1)加入盐酸时,氧化铝与盐酸发生反应的离子方程式为______.
(2)步骤②③④中操作的名称为______.
(3)固体A的化学式为______;物质C的化学式为______:溶液中的Na+、Ca2+、Mg2+是在步骤______中除去的.
(4)步骤③中调节溶液pH的数值范围为______,步骤④中调节溶液pH的数值范围为______.
(5)步骤⑥中发生反应的化学方程式为______.
参考答案:(1)氧化铝和盐酸反应生成氯化铝和水,离子反应方程式为:Al2O3+6H+=2Al3++3H2O,
故答案为:Al2O3+6H+=2Al3++3H2O;
(2)分离液态和不溶性固体采用过滤的方法,故答案为:过滤;
(3)二氧化硅和盐酸不反应,所以A固体物质是SiO2,步骤③中加入的物质C中和盐酸,且除去铁离子,应该碱,一般常用NaOH? 或Ca(OH)2溶液,步骤④中调节溶液pH,使铝离子完全沉淀,而其它离子不沉淀,所以溶液中的Na+、Ca2+、Mg2+是在步骤④中除去的,
故答案为:SiO2;NaOH? 或Ca(OH)2;④;
(4)根据表格知,步骤③中要完全除去铁离子,溶液的pH=4.1,pH=4时铝离子开始沉淀,pH=5.2时铝离子完全沉淀,所以要完全除去铁离子,溶液的4.1<pH<4.5;
步骤④中要使铝离子完全沉淀,溶液的pH=5.2,亚铁离子开始沉淀溶液的pH=10.4,所以要使铝离子沉淀完全而亚铁离子不产生沉淀,则溶液的5.2<pH<10.4,
故答案为:4.1<pH<4.5;5.2<pH<10.4;
(5)工业上采用电解氧化铝的方法冶炼铝,反应方程式为:2Al2O3?电解?.冰晶石4Al+3O2↑,故答案为:2Al2O3?电解?.冰晶石4Al+3O2↑.
本题解析:
本题难度:一般
4、简答题 (13分)某种电池的正极材料,可通过下列方法制得:
①称取一定量的固体铁氧体磁性材料溶于过量盐酸,接着先后加入双氧水和氢氧化钠溶液,静置24 h,过滤
②将沉淀加入反应瓶中,加入过量的氢氟酸溶液,80"c恒温加热24 ha
③蒸发多余氢氟酸和水,得淡红色FeF3凝胶
④在干燥箱中,以1000C预处理6 h,最后掺入铁氧体磁性材料混合研磨制得正极材料
(1)加入双氧水的作用是___(用离子方程式表示)
(2)步骤②的反应瓶材质可能是___(填序号)
A.玻璃 B.陶瓷 C.聚四氟乙烯
(3)加氢氟酸反生反应的化学方程式为____
(4)从安全的角度考虑,在实验室里制三氟化铁时应在____中进行
(5)三氟化铁与Li在固体电解质铁氧体中发生置换反应,产生的电流可供电脑使用,该电池反
应的化学方程式为____
(6)取上述铁氧体样品溶于足量盐酸,在通入标准状况下672 mL C12, Fe2+恰好被完全氧化成
Fe3十,然后把溶液蒸干,灼烧至恒重得9.6 g固体,则该铁氧体的化学式为____。
参考答案:(13分)
(1)2Fe2++H2O2+2H+=2Fe3++2H2O(2分) (2)C(2分)
(3)Fe(OH)3+3HF=FeF3+3H2O(2分) (4)通风橱(或密闭容器)(2分)
(5)FeF3+3Li=Fe+3LiF(2分) (6)Fe4O5(或2FeO?Fe2O3)(3分)
本题解析:(1)H2O2把Fe2+氧化为Fe3+,在酸性条件下的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O
(2)步骤②加入了过量的氢氟酸溶液,玻璃和陶瓷中含有二氧化硅,而二氧化硅能与氢氟酸反应,所以A、B项错误,故C项正确。
(3)沉淀为Fe(OH)3,加入氢氟酸发生酸碱中和反应,化学方程式为:Fe(OH)3+3HF=FeF3+3H2O
(4)反应过程中,挥发出腐蚀性气体HF,所以从安全的角度考虑,在实验室里制三氟化铁时应在通风橱(或密闭容器)中进行。
(5)Li的活泼性大于Fe,所以三氟化铁与Li发生置换反应的化学方程式为:FeF3+3Li=Fe+3LiF
(6)Cl2的物质的量为0.672L÷22.4L/mol=0.03mol,Cl2氧化Fe2+为Fe3+,根据电子转移守恒可知Fe2+的物质的量为0.03mol×2=0.06mol,故氧化物中+2价铁的物质的量为0.06mol,最后所得为氯化铁溶液,蒸干溶液,灼烧至恒重,得9.6g固体为Fe2O3,Fe2O3的物质的量为9.6g÷160g/mol=0.06mol,利用铁元素守恒可知氧化物中+3价铁的物质的量为0.06mol×2-0.06mol=0.06mol,所以铁氧体样品含Fe2O3的物质的量为:0.03mol,所以该铁氧体的化学式为Fe4O5(或2FeO?Fe2O3)
本题难度:一般
5、填空题 已知A~I均为中学化学中的常见物质,它们之间的转化关系如图所示,其中A、D为金属单质,反应过程中需要或生成的水及其他部分产物已略去。请回答以下问题:
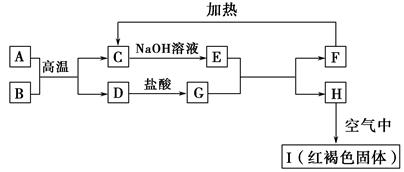
(1)B和F分别是?(填化学式)。
(2)写出下列反应的化学方程式:
①A与B在高温下反应:?。
②H在空气中转变为I:?。
(3)E溶液中所有离子浓度由大到小的顺序是?。
(4)用离子反应方程式表示G溶液呈酸性的原因?;该反应的平衡常数为?(已知常温下,H的溶度积常数Ksp=8.0×10-16)。
参考答案:(1)Fe2O3、Al(OH)3
(2)①Fe2O3+2Al 2Fe+Al2O3
2Fe+Al2O3
②4Fe(OH)2+2H2O+O2=4Fe(OH)3
(3)c(Na+)>c([AlCO4]-)>c(OH-)>c(H+)
(4)Fe2++2H2O Fe(OH)2+2H+ 1.25×10-13
Fe(OH)2+2H+ 1.25×10-13
本题解析:本题以无机框图为载体,考查无机物的性质及化学反应原理,意在考查考生的综合分析能力。(1)根据框中转化关系及题干信息,可以确定I为氢氧化铁。A、D为金属单质,根据A和B的反应条件就可以联想到铝热反应,推测A、D为铝和铁,即A为铝,B为氧化铁,C为氧化铝,D为铁,E为偏铝酸钠,G为氯化亚铁,F为氢氧化铝,H为氢氧化亚铁,I为氢氧化铁。偏铝酸钠水解使溶液呈碱性,所以溶液中离子浓度的大小顺序为c(Na+)>c(AlO2-)>c(OH-)>c(H+);FeCl2溶液中,Fe2+发生水解:Fe2++2H2O Fe(OH)2+2H+,平衡常数K=
Fe(OH)2+2H+,平衡常数K=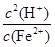 =
=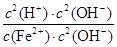 =
= =1.25×10-13。
=1.25×10-13。
本题难度:一般