微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将32g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L,则生成的NO和NO2的体积之比为(?)
A.1:2
B.2:1
C.1:1
D.4:1
参考答案:C
本题解析:设生成的NO和NO2的物质的量是x和y。混合气的物质的量是0.5mol,则x+y=0.5mol。铜的物质的量是0.5mol,失去0.5mol×2=1mol电子。则根据电子得失守恒可知,3x+y=1mol,解得x=y=0.25mol,所以生成的NO和NO2的体积之比为1:1,答案选C。
点评:该题是中等难度的试题,试题贴近高考,基础性强,侧重能力的培养和解题方法与技巧的训练,有助于培养学生的创新思维能力,提高学生分析问题、解决问题的能力。该题的关键是利用好计算题中的守恒法,即质量守恒定律、电子得失守恒、原子守恒等,需要学生在平时的学习中积累、总结,并能灵活运用。
本题难度:简单
2、实验题

(1)烧瓶A中加入碎瓷片,其作用是?;装置C处烧杯中加冰水的作用是__?___?_。
(2)装置B中发生反应的化学方程式是__?____;装置E中发生反应的化学方程式是___?____。
(3)为了安全,在装置E中的反应发生前,在F出口处必须?;
(4)某次实验后,取B中的固体物质少量,溶于足量稀盐酸,再滴 加KSCN溶液。溶液颜色无明显变化,试解释原因?。
加KSCN溶液。溶液颜色无明显变化,试解释原因?。
参考答案:

本题解析:略
本题难度:一般
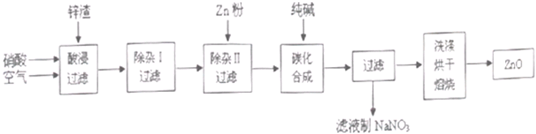
3、简答题 现从锌制品加工企业回收的废渣(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质)来制取氧化锌,流程如下:
有关氢氧化物完全沉淀的pH见下表
| 沉淀物 | AI(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2
pH
5.2
3.2
9.7
6.7
8.0
|
(l)在酸浸过程中,要提高浸出率,可以采取______措施.
(2)上述流程中多处涉及“过滤’,实验室中过滤操作需要使用的玻璃仪器有______.
(3)在“除杂I”步骤中,将溶液调至pH=4的目的是______.
在“除杂Ⅱ”后,溶液的pH约为6,则此步过滤时滤渣中含有______.
(4)在“碳化合成”中,生成的产物之一为碱式碳酸锌[Zn2(OH)2CO3],同时放出CO2,请写出该反应的化学方程式______.
(5)从滤液中提取NaNO3晶体的操作步骤为______.
(6)在实验室如何洗涤过滤出的碱式碳酸锌?______.
参考答案:(1)因适当升高反应温度(或增大硝酸浓度、将锌废渣粉碎等)、搅拌可提高锌的浸出速率,故答案为:加热、搅拌;
(2)过滤操作需要使用的玻璃仪器有烧杯、玻璃棒、漏斗,故答案为:烧杯、玻璃棒、漏斗;
(3)“除杂I”步骤中,将溶液调至pH=4,可以让三价铁转化为氢氧化铁沉淀而除去,在“除杂Ⅱ”后,溶液的pH约为6,此时氢氧化铝沉淀依然存在,并且过程中会发生置换反应产生金属Cu和金属Zn,则此步过滤时滤渣中含有Al(OH)3、Cu、Fe,故答案为:使三价铁转化为氢氧化铁沉淀除去;Al(OH)3、Cu、Fe;
(4)在“碳化合成”中,是碳酸钠和硝酸锌的水溶液之间发生反应生成产物之一为碱式碳酸锌[Zn2(OH)2CO3],同时放出CO2,即2Na2CO3+2Zn(NO3)2+H2O=[Zn2(OH)2CO3+CO2+4NaNO3,故答案为:2Na2CO3+2Zn(NO3)2+H2O=[Zn2(OH)2CO3+CO2+4NaNO3;
(5)根据物质的溶解度受温度的影响,从滤液中提取NaNO3晶体的操作步骤为蒸发浓缩、冷却结晶、过滤,故答案为:蒸发浓缩、冷却结晶、过滤;
(6)碱式碳酸锌的洗涤方法:往漏斗中加入少量的蒸馏水,浸没沉淀,让其自然滤出,反复几次,故答案为:往漏斗中加入少量的蒸馏水,浸没沉淀,让其自然滤出,反复几次.
本题解析:
本题难度:一般
4、填空题 某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:
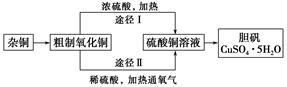
(1)杂铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于?上(用以下所给仪器的编号填入,下同),取用坩埚应使用?,灼烧后的坩埚应放在?上,不能直接放在桌面上。
实验所用仪器:
a.蒸发皿
b.石棉网
c.泥三角
d.表面皿
e.坩埚钳
f.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,灼烧后含有少量铜的可能原因是?。
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、?、冷却结晶、?、自然干燥。
(4)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是?、?。
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行?次。
(6)若测定结果x值偏高,可能的原因是?(填字母编号)。
a.加热温度过高
b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却
d.胆矾晶体部分风化
参考答案:(1)c e b
(2)a、b
(3)蒸发 过滤
(4)产生等量胆矾途径Ⅱ消耗硫酸少,途径Ⅱ不会产生污染大气的气体
(5)4
(6)a
本题解析:(1)因加热坩埚时温度较高,应放在泥三角上进行加热,且取用坩埚时要用坩埚钳,并且为防止坩埚炸裂和烧坏桌面,烧后的坩埚要在石棉网上冷却,不能直接放在桌面上。(2)灼烧后含有少量铜,其原因可能是灼烧不充分,铜未被完全氧化,也可能是灼烧过程中部分氧化铜被还原。(3)利用途径Ⅱ制取胆矾时,必须先加酸将氧化铜溶解,加热通氧气将Cu氧化,过滤除去粗制氧化铜中的不溶物杂质后,然后再蒸发溶剂,冷却结晶,再过滤得晶体,最后将其干燥,由此可写出答案。(4)根据途径Ⅰ的反应化学方程式Cu+2H2SO4(浓)  CuSO4+SO2↑+2H2O和途径Ⅱ的反应化学方程式2Cu+O2+2H2SO4(稀)
CuSO4+SO2↑+2H2O和途径Ⅱ的反应化学方程式2Cu+O2+2H2SO4(稀)  2CuSO4+2H2O,可以看出途径Ⅱ的优点是:①产生等量的胆矾比途径Ⅰ耗硫酸少;②途径Ⅱ不产生污染大气的气体(SO2)。(5)称量操作至少进行4次,分别是:①称量坩埚;②称量加入晶体后的坩埚;③称量加热冷却后的坩埚;④称量再加热、再冷却后的坩埚至两次称量的值相差不超过0.1 g。(6)若测定结果x值偏高,可能是加热温度过高使CuSO4晶体中的CuSO4分解了,其他三项均使x值偏低。
2CuSO4+2H2O,可以看出途径Ⅱ的优点是:①产生等量的胆矾比途径Ⅰ耗硫酸少;②途径Ⅱ不产生污染大气的气体(SO2)。(5)称量操作至少进行4次,分别是:①称量坩埚;②称量加入晶体后的坩埚;③称量加热冷却后的坩埚;④称量再加热、再冷却后的坩埚至两次称量的值相差不超过0.1 g。(6)若测定结果x值偏高,可能是加热温度过高使CuSO4晶体中的CuSO4分解了,其他三项均使x值偏低。
本题难度:一般
5、填空题 铜是生命必需的元素,也是人类最早使用的金属之一,铜的生产和使用对国计民生各个方面产生了深远的影响。请完成(1)~(3)题:
(1)在西汉古籍中曾有记载:曾青得铁则化为铜[即曾青(CuSO4)与铁反应生成铜]。试写出该反应的化学方程式: _____________________________。
(2)铜器表面有时会生成铜绿,请写出生成铜绿的化学方程式:____________________________。
这层铜绿可以用化学方法除去,试写出除去铜绿而不损伤器物的化学方程式: _________________________。
(3)铜钱在历史上曾经是一种广泛流通的货币。试从物理性质和化学性质的角度分析为什么铜常用于制造货币。(铜的熔点是1 183.4 ℃,铁的熔点是1 534.8 ℃)_________________ ___________。
参考答案:(1)Fe+CuSO4=FeSO4+Cu
(2)2Cu+O2+H2O+CO2=Cu2(OH)2CO3
Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O
(3)选择铜做货币是因为铜的熔点比较低,容易铸造成型;铜的化学性质比较稳定,不易被腐蚀
本题解析:本题考查有关铜的冶炼方法、铜化合物的性质,同时考查了有关铜的
应用。一方面要注意铜的性质很稳定,不易发生化学反应。但又应知道这种
稳定性是相对的,在适宜条件下也会与一些物质反应。
本题难度:一般