微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 工业上制备氯化铜时,是将浓盐酸用蒸气加热至80℃左右,慢慢加入粗制氧化铜粉末(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:
CuO+2HCl=CuCl2+H2O
FeO+2HCl=FeCl2+H2O
已知:pH≥9.6时,Fe2+以Fe(OH)2形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.除去溶液中的Fe2+,可以采用的方法是? ( )
A.直接加碱,调整溶液pH≥9.6
B.加纯铜粉,将Fe2+还原出来
C.先将Fe2+氧化成Fe3+,再调整pH在3~4
D.通入硫化氢,使Fe2+直接沉淀
参考答案:C
本题解析:依据题意,应先把Fe2+氧化为Fe3+,然后再调节溶液的pH值,使Fe3+转化为Fe(OH)3除去,故C正确。
本题难度:简单
2、选择题 在硫酸铁溶液中,加入a g铜,完全溶解后,又加入b g铁,充分反应后得到c g残余固体,且b<c,则下列判断正确的是? ( )
A.最后得到的溶液中含有Fe3+
B.残余固体可能为铁、铜混合物
C.最后得到的溶液中只含Cu2+
D.残余固体一定全部是铜
参考答案:B
本题解析:本题涉及的反应有:(1)Cu+2Fe3+==Cu2++2Fe2+,(2)Fe+Cu2+==Fe2++Cu,所以C不正确;由于题目中b<c,说明所加的Fe的量不确定,若Fe的量不足,说明Cu没有被全部置换出来,Cu2+ 没有完全反应掉,故残留固体全部为Cu;若Fe过量,且符合b<c,则残余固体可能为铁、铜混合物,所以B正确,D不正确;因为Fe3+能够氧化Cu,所以当残留固体中有Cu存在时,溶液中一定不含有Fe3+,所以A不正确。故选B。
点评:本题主要考查铁及其化合物的知识,要求会判断反应物与产物,题目难度中等。
本题难度:简单
3、简答题 某同学采用如图所示装置进行Fe粉与水蒸气的反应.
(1)写出Fe粉与水蒸气反应的化学方程式______.
(2)该同学向反应后的固体中加入过量的稀HCl,并将溶液分装在两支试管中.
①向第一支试管中滴加KSCN溶液,溶液呈红色,该溶液中存在的阳离子有______.
②向第二支试管中加入适量铁粉.该过程中发生化合反应的离子方程式是______.
再向所得溶液中滴加NaOH溶液并放置一段时间,该步反应中的实验现象是______.发生的氧化还原反应的化学方程式是______.
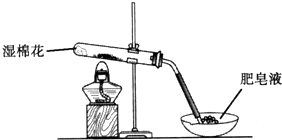
参考答案:(1)该反应的化学方程式是:3Fe+4H2O(g) 高温.Fe3O4+4H2;
故答案是:3Fe+4H2O(g) 高温.Fe3O4+4H2;
(2)①滴加KSCN溶液,溶液呈红色,证明有Fe3+,反应后的固体中一定含有剩余的铁,和盐酸反应生成氯化亚铁,溶液中含有氢离子;
故答案是:Fe3+、Fe2+、H+;
②加入适量铁粉,铁和Fe3+反应,反应的离子方程式是:2Fe3++Fe═3 Fe2+;加入氢氧化钠溶液后,现象是:产生白色沉淀,迅变成灰绿色,最终速变成红褐色;反应的化学方程式为:4Fe(OH)2+O2+2 H2O═4 Fe(OH)3 ;
故答案是:2Fe3++Fe═3 Fe2+; 产生白色沉淀,迅变成灰绿色,最终速变成红褐; 4Fe(OH)2+O2+2 H2O═4 Fe(OH)3 .
本题解析:
本题难度:简单
4、选择题 制印刷电路时常用氯化铁溶液作为“腐蚀液”:发生的反应:2FeCl3+Cu=2FeCl2+CuCl2向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是(?)
A.烧杯中有铜无铁
B.烧杯中有铁无铜
C.烧杯中铁、铜都有
D.烧杯中铁、铜都无
参考答案:B
本题解析:向盛有FeCl3溶液的烧杯中同时加入铁粉和铜粉,由于Fe的还原性比Cu强,Fe3+首先应与Fe反应,如果Fe3+有剩余,剩余的Fe3+再与Cu反应。铁粉未反应完时铜粉就不会被氧化,所以不可能出现烧杯中有铁无铜的现象,故应选B。其他三个选项的情况都可能再现。当FeCl3过量或恰好完全反应时,Fe、Cu均无剩余,即选项D,反应后溶液中有Fe3+、Fe2+、Cu2+或Fe2+、Cu2+。当FeCl3不足量时,有两种情况:①Fe粉有剩余,则Cu尚未参加反应,即选项C,反应后溶液中只有Fe2+(不考虑H+、OH-);②铁粉无剩余,则Cu反应了一部分或尚未参加反应,即选项A,反应后溶液中有Fe2+、Cu2+或只有Fe2+。
本题难度:简单
5、选择题 某化学兴趣小组把少量废铁屑溶于过量稀硫酸中,过滤,除去杂质,在滤液中加入适量硝酸,再加入过量的氨水,有红褐色沉淀A生成。再过滤,加热至恒重得到B。对物质A、B该小组有如下四种判断,你认为正确的是(?)
A. Fe(OH)3; Fe2O3? B. Fe(OH)2; FeO?
C. Fe(OH)3、Fe(OH)2;Fe3O4?D. Fe2O3?;Fe(OH)3
参考答案:A
本题解析:有关转化关系为Fe
H2SO4
?
Fe2+
HNO3
?
Fe3+
氨水
?
Fe(OH)3
加热
?
Fe2O3
红褐色沉淀生成为Fe(OH)3,Fe(OH)3不稳定,在加热时分解生成红棕色的Fe2O3,而Fe(OH)2为白色沉淀,
FeO和Fe3O4都为黑色物质.
故选A.
本题难度:简单