微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 下表是常温下,浓度为0.01mol-L-1的NaOH溶液与几种酸或盐混合后的情况:
| 混合组别 | 混合前酸或盐的总浓度 | 混合比例及混合溶液性质
A
c(HA)=0.02mol-L-1
等体积混合,pH>7
B
HB溶液的pH=2
V1?mL?NaOH溶液与V2?mL?HB溶液,pH=7
C
c(H2C)=0.01mol-L-1
等体积混合,pH>7
D
c(NaHD)=0.01mol-L-1
等体积混合,pH=7
|
回答下列问题:
(1)A组混合液中,HA、A-、Na+三种粒子浓度由大到小的顺序为______,若pH=8,则c(Na+)-c(A-)=______mol-L-1(填具体数字).
(2)由B组混合液pH=7可推知,V1______V2.
(3)C组混合液中,pH>7的原因是______.
(4)0.01mol-L-1NaHD溶液中,水的电离度(已电离的量与初始总量之比)=______.
(5)仅凭上述结果,一定能确定HA、HB、H2C、H2D四种酸中属于弱酸的是______.
参考答案:(1)A组等体积等浓度混合,得到等量的HA、NaA,pH>7,水解显碱性,则离子浓度为c(HA)>c(Na+)>c(A-);pH=8,c(H+)=10-8mol/L,c(OH-)=10-6mol/L,则c(Na+)-c(A-)=c(OH-)-c(H+)=9.9×10-7mol/L,
故答案为:c(HA)>c(Na+)>c(A-);9.9×10-7;
(2)若HB为强酸,pH=7,等体积混合;若HB为弱酸,HB的浓度大于0.01mol/L,则酸的体积小可保证pH=7,即V1≥V2,故答案为:≥;
(3)酸为二元酸,等体积等浓度混合后,为盐和酸的混合液,溶液pH>7,则盐中HC-的水解大于其电离,故答案为:HC-的水解大于其电离;
(4)由等体积等浓度混合pH=7,则NaHD完全电离,c(H+)=0.01mol/L,由水电离出的c(H+)=10-12mol/L,1L水电离出n(H+)=10-12mol,
1L水的物质的量为100018mol,则水的电离度为10-12100018×100%=1.8×10-14,故答案为:1.8×10-14;
(5)由上述分析可知,A、C组中的酸不能完全电离,而B组中不能确定,D组中为强酸,所以属于弱酸的为HA、H2C,故答案为:HA、H2C.
本题解析:
本题难度:一般
2、简答题 有关pH的计算
(1)20mL0.01mol/LKOH溶液的pH为?
(2)30mL0.005mol/LH2SO4溶液的pH为?
(3)两溶液混合后,溶液的pH为?
参考答案:(1)20mL0.01mol/LKOH溶液中c(OH-)=0.01mol/L,故溶液中c(H+)=10-140.01mol/L=10-12mol/L,故该溶液的pH=-log10-12=12,
答:0.01mol/LKOH溶液的pH为12;
(2)30mL0.005mol/LH2SO4溶液中c(H+)=0.005mol/L×2=0.01mol/L,故该溶液的pH=-log0.01=2,
答:0.005mol/LH2SO4溶液的pH为2;
(3)KOH溶液中c(OH-)=0.01mol/L,H2SO4溶液中c(H+)=0.005mol/L×2=0.01mol/L,硫酸的体积多,故混合后溶液呈酸性,胡混合后溶液中c(H+)=0.03L×0.01mol/L-0.02L×0.01mol/L0.03L+0.02L=0.002mol/L,故混合后溶液的pH=-log0.002=2.7,
答:混合后溶液的pH值为2.7.
本题解析:
本题难度:一般
3、选择题 常温下,适合马铃薯生长的土壤的pH大致是5,其中的c(OH-)最接近于( )
A.0.01mol/L
B.1×10-5mol/L
C.1×10-7mol/L
D.1×10-9mol/L
参考答案:D
本题解析:
本题难度:一般
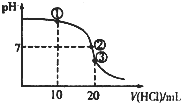
4、选择题 常温下,将0.1mol.L-1.盐酸逐滴加入到20mL0.1mol?L-1氨水中,测得溶液的pH随加入盐酸的体积变化如图所示.下列说法正确的是( )
A.①溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.②溶液中:c(NH?4+)=c(Cl-)=c(OH-)=c(H+)
C.③溶液中:c(Cl-)+c(H+)=c(NH4+)+c(OH-)
D.滴定过程中可能出现:c(NH3H?2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+)