微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是(? )
A.原混合溶液中c(K+)为1 mol·L-1
B.上述电解过程中共转移4 mol电子
C.电解得到的Cu的物质的量为0.5 mol
D.电解后溶液中c(H+)为2 mol·L-1
参考答案:B
本题解析:电解KNO3和Cu(NO3)2的混合溶液,在阳极发生反应:4OH—-4e-=2H2O+O2↑。n(O2)= 22.4 L÷22.4L/mol=1mol。则转移电子4mol.因此选项B正确;在阴极首先发生反应:Cu2++2e-=Cu,然后发生:2H++2e-=H2↑。由于产生氢气的物质的量是1mol,得到电子2mol,则产生Cu转移的电子也是2mol,产生Cu1mol。所以选项C错误;Cu(NO3)2的物质的量是1mol,根据N守恒可得n(KNO3)= 6.0 mol/L×0.5L-2mol=1mol,所以c(K+)= c(KNO3)=1mol÷0.5L=2mol/L,选项A错误;因为在反应过程中放电的OH-的物质的量与H+及电子的物质的量相等,因为电子转移4mol,所以电解后溶液中H+的物质的量也是4mol,所以c(H+)=4mol÷0.5L=8mol/L ,所以选项D错误。
本题难度:一般
2、实验题 碘酸钾(KIO3)晶体是我国规定的食盐加碘剂。它通常是以碘为原料与过量KOH溶液通过下列反应制得:3I2+6KOH=5KI+KIO3+3H2O,再将KI和KIO3的混合溶液电解,将其中的I
参考答案:
本题解析:
本题难度:困难
3、填空题 (15分)
次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式:
(2)H3PO2及NaH2PO2)均可将溶液中的银离子还原为银单质,从而可用于化学镀银。
①(H3PO2)中,磷元素的化合价为
②利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4
参考答案:
本题解析:
本题难度:困难
4、选择题 Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图所示,电解总反应为
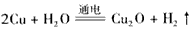 ,下列说法正确的是
,下列说法正确的是
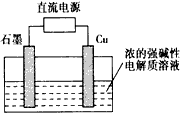
[? ]
A.石墨电极上产生氢气
B.铜电极发生还原反应
C.铜电极接直流电源的负极
D.当有0.1 mol电子转移时,有0.1 mol Cu2O生成
参考答案:A
本题解析:
本题难度:一般
5、选择题 在水中加入等物质的量的AgNO3、Ba(NO3)2、NaCl、K2SO4混合均匀.取一定量溶液,用惰性电极电解,片刻后在两个极区析出的氧化产物与还原产物的质量之比为( )
A.35.5∶108
B.1∶2
C.108∶35.5
D.8∶1
参考答案:D
本题解析:设各物质均为1mol则AgNO3+NaCl= AgCl↓+NaNO3,Ba(NO3)2+K2SO4= BaSO4↓+2KNO3
1mol? 1mol? 1mol? 1mol? 1mol? 1mol? 1mol? 2mol
反应后,变为1mol NaNO3和2mol KNO3的混合物;
阴离子(NO3-、OH-)在电解池的阳极放电,且放电顺序为: OH->NO3-;
阳离子(Na+、K+、H+)在电解池的阴极放电,且放电顺序为: H+>Na+、K+;
则两极反应为4OH—-4e— =2H2O+O2↑(氧化产物); 2H++2e-=H2↑(还原产物),实质为电解水;
4mol? 1mol? 4mol 2mol
即32g:4g=8:1,故选D;
本题难度:一般