微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列器具不属于陶瓷制品的是( )
A.唐三彩
B.砂锅
C.蒸发皿
D.表面皿
参考答案:D
本题解析:
本题难度:一般
2、填空题 硫酸亚锡(SnSO4)可用于镀锡工业.某小组设计SnSO4制备路线为:
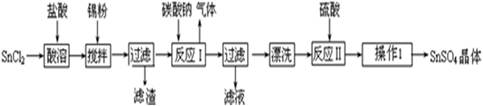
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化.
Ⅱ.SnCl2易水解生成碱式氯化亚锡
(1)锡原子的核电荷数为50,与碳元素同处ⅣA族,锡位于周期表的第?周期(1分)
(2)操作Ⅰ是 ?过滤、洗涤等(2分)
(3)溶解SnCl2粉末需加浓盐酸,原因是??
(4)加入Sn粉的作用有两个:①调节溶液pH?②?
(5)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是?
(6)酸性条件下,SnSO4与双氧水去反应的离子方程式是?
(7)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn+2HCl═SnCl2+H2↑;
②加入过量的FeCl3;
③用已知浓度的K2Cr2O7滴定②生成的Fe2+,再计算锡粉的纯度,请配平方程式:
FeCl2 +?K2Cr2O7 +?HCl = ?FeCl3 + ?KCl + ?CrCl2+?
参考答案:32.(16分)(1)第五周期(1分);?(2)蒸发浓缩、冷却结晶(2分);
(3)?抑制Sn2+ 的水解(2分);?(4)防止Sn2+ 被氧化(2分);
(5)SnCl2 + Na2CO3=" SnO↓+" CO2↑+ 2NaCl(3分,未写↓和↑符号共扣1分,未配平扣1分)
(6)Sn2+ + H2O2 +2H+ = Sn4 + + 2H2O (3分,未配平扣1分)
(7)③ 6? 1? 14? 6? 2? 2? 7 H2O(3分,化学式H2O给1分,系数全对2分)
本题解析:
试题分析: 解:(1)锡元素与碳元素属于同一主族,处于ⅣA族,原子核电荷数为50,则:50-2-8-8-18=14,故Sn处于第五周期。
(2)由流程图可知,操作Ⅰ是从溶液中得到含结晶水的晶体,只能采取蒸发浓缩、冷却结晶、过滤、洗涤得到。
(3)由信息可知,SnCl2易水解生成碱式氯化亚锡,存在水解平衡SnCl2+H2O Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解。
Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解。
(4)由信息可知,Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;?
(5)反应Ⅰ得到沉淀是SnO,Sn元素化合价为变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳,反应方程式为:SnCl2 + Na2CO3=" SnO↓+" CO2↑+ 2NaCl。
(6)酸性条件下,SnSO4还可以用作双氧水去除剂,双氧水有强氧化性,将Sn2+易被氧化为Sn4+,自身被还原为水,离子方程式为:Sn2++H2O2+2H+═Sn4++2H2O。
(7)反应物中有H元素,所以在酸性条件下生成物必为H2O,所以根据的是电子守恒配平的方程式为:6FeCl2+K2Cr2O7+14HCl═6FeCl3+2KCl+2CrCl3+7H2O
本题难度:困难
3、填空题 煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为?和?。
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理如下图所示:
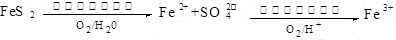 ?
?
这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为??,第二步反应的离子方程式为??。
(3)工业煤干馏得到的产品有焦炭、??。
(4)工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨—空气混合气中氧氨比的关系。其中直线表示反应的理论值;曲线表示生产实际情况。当氨氧化率达到100%,理论上γ{n(O2)/n(NH3)}=??,实际生产要将γ值维护在1.7—2.2之间, 原因是?。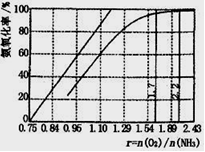
参考答案:(共8分)(1)直接液化技术、间接液化技术(全对给1分)
(2)2FeS2+7O2+2H2O 4H++2Fe2++4SO42-(2分) 4Fe2++O2+4H+
4H++2Fe2++4SO42-(2分) 4Fe2++O2+4H+ 4Fe3++2H2O(2分)
4Fe3++2H2O(2分)
(3)焦炉煤气、粗氨水、煤焦油(全对给1分)
(4)1.25(1分);? O2太少不利于NH3的转化,Υ值为2.2时NH3氧化率已近100%(1分)
本题解析:(1)煤的液化分为直接液化和间接液化技术。
(2)第一步反应中反应物有FeS2、O2和H2O,生成物有Fe2+和SO42-,反应中S元素的化合价从-1价升高到+6价,失去7个电子。氧元素的化合价从0价降低到-2价,所以根据化合价升降总数相等以及原子守恒可知,该反应的离子方程式为2FeS2+7O2+2H2O 4H++2Fe2++4SO42-;Fe2+具有还原性,可被氧气氧化为Fe3+,同样根据化合价升降总数相等以及原子守恒可知,该反应的离子方程式为4Fe2++O2+4H+
4H++2Fe2++4SO42-;Fe2+具有还原性,可被氧气氧化为Fe3+,同样根据化合价升降总数相等以及原子守恒可知,该反应的离子方程式为4Fe2++O2+4H+ 4Fe3++2H2O。
4Fe3++2H2O。
(3)工业煤干馏得到的产品有焦炭、焦炉煤气、粗氨水、煤焦油。
(4)根据氨氧化的化学方程式4NH3+5O2 4NO+6H2O可知,氨氧化率达到100%,理论上γ{n(O2):n(NH3)}=5:4=1.25;由于在反应中O2浓度太少不利于NH3的转化,且在γ{n(O2)/n(NH3)值为2.2时NH3氧化率已近100%,所以实际生产要将γ值维护在1.7—2.2之间。
4NO+6H2O可知,氨氧化率达到100%,理论上γ{n(O2):n(NH3)}=5:4=1.25;由于在反应中O2浓度太少不利于NH3的转化,且在γ{n(O2)/n(NH3)值为2.2时NH3氧化率已近100%,所以实际生产要将γ值维护在1.7—2.2之间。
本题难度:一般
4、选择题 下列物质中,不含有硅酸盐的是( )
A.玻璃
B.黏土
C.硅芯片
D.普通水泥
参考答案:C
本题解析:
本题难度:简单
5、选择题 下列说法正确的是
A.蛋白质、纤维、蔗糖、聚乙烯、淀粉都是高分子化合物
B.研制乙醇汽油(汽油中添加一定比例的乙醇)技术,可以降低机动车辆尾气中有害气体排放
C.使用太阳能热水器、沼气的利用、玉米制乙醇都涉及到生物质能的利用
D.石油、煤、天然气、可燃冰、植物油都属于化石燃料
参考答案:B
本题解析:A.蔗糖不是高分子化合物,排除
B.正确
C.太阳能热水器是将太阳能直接转换为热能,不涉及到生物质能的利用,排除
D.植物油不属于化石燃料
故答案为B
本题难度:一般