微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 若醋酸用HAc表示,则在0.1mol·L-1 NaAc溶液中,下列离子浓度关系正确的是
A.c(Na+)= c(Ac—)+c(HAc)
B.c(Na+)+c(OH—)= c(Ac— )+c(H+)
C.c(Na+)>c(OH—) > c(Ac—) > c(H+)
D.c(Na+)> c(Ac—)> c(H+)> c(OH—)
参考答案:A
本题解析:0.1mol·L-1 NaAc溶液中存在着Na+、Ac-、HAc、H+、OH-。其溶液中的三个守恒式为:①物料守恒:c(Na+)=c(Ac—)+c(HAc)=0.1mol·L-1 ;②电荷守恒:c(Na+)+c(H+)= c(Ac— )+c(OH—);③质子守恒:c(OH—)=c(H+)+c(HAc);由于离子的水解,故溶液中各离子的浓度大小关系为:c(Na+)> c(Ac—)> c(OH—)> c(H+)。综上,答案选A。
点评:解答此题的关键在于熟练掌握电解质溶液中的三个守恒:物料守恒、质子守恒和电荷守恒。同时,应充分考虑弱离子的电离与水解。属于中档题。
本题难度:一般
2、填空题 在室温下,下列五种溶液①0.1mol/LNH4Cl?②0.1mol/LCH3COONH4?③ 0.1mol/ L NH4HSO4?④0.1mol/LNH3·H2O和0.1mol/LNH4Cl的混合溶液?⑤0.1mol/LNH
0.1mol/ L NH4HSO4?④0.1mol/LNH3·H2O和0.1mol/LNH4Cl的混合溶液?⑤0.1mol/LNH 3·H2O
3·H2O
(1)溶液①呈___性(填“酸”“碱”或“中”)其原因是____________________________(用离子方程式表示)
(2 )比较溶液②、③中C(NH4+)的大小关系是____________________(填>,<或=)
)比较溶液②、③中C(NH4+)的大小关系是____________________(填>,<或=)
(3)在溶液④中,_____________离子的浓度为0.1mol/L
NH3·H2O和_________离子的物质的量浓度之和为0.2mol/L
(4) 室温下测得溶液②的PH=7,则说明CH3COO-的水解程度_______(填>,<或=")" NH4+的水解程度,C(CH3COO-)_________C(NH4+)(填>,<或=)
参考答案:1)酸 , NH4++H2O N
N H3·H2O+H+?,N
H3·H2O+H+?,N H4+和水电离出来
H4+和水电离出来 的结合成NH3
的结合成NH3 ·H
·H 2O,促进水
2O,促进水 的电离,平衡时使C(H+)
的电离,平衡时使C(H+) >C(OH-),所以溶液呈酸性。(2)②<③? (3)Cl- ,? NH4+?(4)? ="?" ,
>C(OH-),所以溶液呈酸性。(2)②<③? (3)Cl- ,? NH4+?(4)? ="?" , =
=
本题解析:略
本题难度:一般
3、选择题 下列离子既能电离又能水解,且能与强碱溶液反应的是( )
A.CH3COO-
B.HSO4-
C.HSO3-
D.CO32-
参考答案:C
本题解析:CH3COO-与CO32-不能再电离,A、D不选;H2SO4是强酸HSO4-不能水解,B不选;答案选C。
本题难度:一般
4、选择题 下列物质溶解于水时,电离出的阴离子能使水的电离平衡向右移动的是(?)
A.Na2SO4
B.CH3COONa
C.NH4Cl
D.HClO
参考答案:B
本题解析:A 对水的电离平衡无影响
B 醋酸根离子会水解,促进水的电离
C 铵根离子会水解,促进水的电离,但是铵根离子是阳离子,不是阴离子
D HclO会抑制水的电离
故选B
本题难度:一般
5、选择题 常温下,对下列各溶液的叙述不正确的是(?)
A.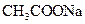 溶液中:
溶液中: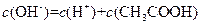

B.在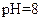 的
的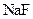 溶液中,
溶液中,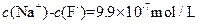
C.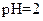 的盐酸与
的盐酸与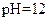 的
的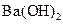 溶液等体积混合后,溶液中一定有
溶液等体积混合后,溶液中一定有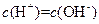
D.向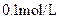 氨水中加入少量
氨水中加入少量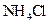 固体,溶液中
固体,溶液中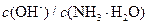 增大
增大
参考答案:D
本题解析:略
本题难度:一般