微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某实验小组同学为了探究SO2的性质,进行了如下实验(实验前,装置内空气已排尽):
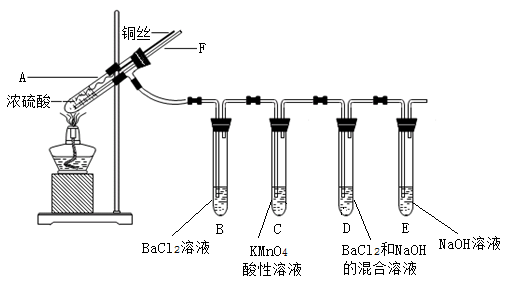
已知:硫酸的沸点是338℃,酒精灯可加热至400℃以上。
主要实验步骤:
①加热试管A直到B、D中均出现大量白色沉淀,熄灭酒精灯;
②将Cu丝上提离开液面;
③从导管F口向装置中通入空气一段时间。
(1)试管A中发生的主要反应的化学方程式为 。
(2)试管B中出现白色沉淀的原因是 。
(3)试管C中溶液褪色,说明SO2具有 (填“漂白性”或“氧化性”或“还原性”),请将该反应的离子方程式补充完整:
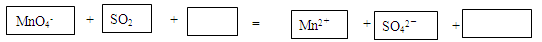
(4)试管D中发生反应的离子方程式为 。
(5)下列叙述正确的是 。
a.上下移动铜丝可控制生成SO2的量
b.为确认有CuSO4生成,可向试管A中加水,观察颜色
c.步骤③可使装置中残留气体完全被吸收,避免污染空气
d.熄灭酒精灯后, B中的液体不会倒吸,因为空气可经导管F进入试管A,使压强平衡
参考答案:(1)Cu+2H2SO4(浓)  CuSO4+SO2↑+2H2O (2)蒸发出的硫酸与氯化钡反应生成了硫酸钡
CuSO4+SO2↑+2H2O (2)蒸发出的硫酸与氯化钡反应生成了硫酸钡
(3)还原性, 2MnO4- + 5SO2 +2H2O = 2Mn2++ 5SO42- + 4H+(4)SO2+ 2OH—+Ba2+=BaSO3↓+ H2O (5)acd
本题解析:(1)验证SO2的性质,首先制备SO2,根据实验:A中用铜丝和浓硫酸加热制备SO2,Cu+2H2SO4(浓)  CuSO4+SO2↑+2H2O;(2)硫酸的沸点338℃,酒精灯可加热至400℃以上,部分硫酸被蒸发出来,与BaCl2反应生成硫酸钡沉淀,BaCl2+H2SO4=BaSO4↓+2HCl;(3)酸性KMnO4具有强氧化性,SO2既具有氧化性也具有还原性,遇到强氧化性的物质时,表现还原性,因此SO2在此表现还原性,MnO4-→Mn2+,化合价由+7价变成了+2价↓5,SO2→SO42-化合价由+4价变成了+6价↑2,最小公倍数是10,MnO4-、Mn2+系数是2,SO2、SO42-的系数是5,根据反应前后所带电荷数相等,有H2O参加,有H+生成,根据反应前后原子个数守恒:2MnO4- + 5SO2 +2H2O = 2Mn2++ 5SO42- + 4H+;(5)SO2是酸性氧化物,SO2+2NaOH=Na2SO3+H2O,BaCl2+Na2SO3=BaSO3↓+2NaCl,两式合并得到离子反应方程式:SO2+ 2OH—+Ba2+=BaSO3↓+ H2O;(5)a、上下移动铜丝可控制反应的进行,节约原料,正确;b、A中反应生成的CuSO4是溶液,加水稀释,变浅,不能说明生成CuSO4,错误;c、SO2有毒对环境有污染,必须除去,正确;d、熄灭酒精灯后,B中不会引起倒吸,因为内外压强相等,正确;因此acd正确。
CuSO4+SO2↑+2H2O;(2)硫酸的沸点338℃,酒精灯可加热至400℃以上,部分硫酸被蒸发出来,与BaCl2反应生成硫酸钡沉淀,BaCl2+H2SO4=BaSO4↓+2HCl;(3)酸性KMnO4具有强氧化性,SO2既具有氧化性也具有还原性,遇到强氧化性的物质时,表现还原性,因此SO2在此表现还原性,MnO4-→Mn2+,化合价由+7价变成了+2价↓5,SO2→SO42-化合价由+4价变成了+6价↑2,最小公倍数是10,MnO4-、Mn2+系数是2,SO2、SO42-的系数是5,根据反应前后所带电荷数相等,有H2O参加,有H+生成,根据反应前后原子个数守恒:2MnO4- + 5SO2 +2H2O = 2Mn2++ 5SO42- + 4H+;(5)SO2是酸性氧化物,SO2+2NaOH=Na2SO3+H2O,BaCl2+Na2SO3=BaSO3↓+2NaCl,两式合并得到离子反应方程式:SO2+ 2OH—+Ba2+=BaSO3↓+ H2O;(5)a、上下移动铜丝可控制反应的进行,节约原料,正确;b、A中反应生成的CuSO4是溶液,加水稀释,变浅,不能说明生成CuSO4,错误;c、SO2有毒对环境有污染,必须除去,正确;d、熄灭酒精灯后,B中不会引起倒吸,因为内外压强相等,正确;因此acd正确。
考点:考查二氧化硫的制备和性质、氧化还原反应的配平。
本题难度:困难
2、选择题 下列材料属于复合材料的是
A.合金
B.玻璃钢
C.隔热陶瓷瓦
D.耐高温结构陶瓷
参考答案:B、C
本题解析:合金是由两种或两种以上的金属或非金属融合而成的具有金属特性的物质,不属于复合材料。耐高温结构陶瓷多是单一材料,如氮化硅结构陶瓷等。玻璃钢是玻璃纤维和合成树脂形成的复合材料。隔热陶瓷瓦是由纤维(如碳纤维)和陶瓷形成的复合材料
本题难度:简单
3、选择题 某元素的单质与足量浓HNO3反应时,参加反应的单质与HNO3的物质的量之比为1∶4,则反应后的产物中,该元素的价态可能为?
A.+1
B.+5
C.+3
D.+4
参考答案:D
本题解析:浓硝酸的还原产物是NO2,转移的电子是1.根据得失电子守恒可知生成4mol还原产物转移4mol电子,所以1mol单质失去4mol电子,化合价是+4价,答案选D。
本题难度:一般
4、填空题 氢气还原氧化铜所得的红色固体可能是铜与氧化亚铜的混合物,已知Cu2O在酸性溶液中可发生自身氧化还原反应,生成Cu2+和Cu。
(1)现有8.4克氧化铜被氢气完全还原后,得到红色固体6.96克,其中含单质铜与氧化亚铜的物质的量之比是?;
(2)若将6.96克上述混合物与足量的浓硝酸充分反应:
①生成标准状况下1.568升的气体(不考虑NO2的溶解,也不考虑NO2与N2O4的转化),则该气体的成分是?,其物质的量之比是?;
②把得到的溶液小心蒸发浓缩,把析出的晶体过滤,得晶体20.328g。经分析,原溶液中的Cu2+有20%残留在母液中,所得晶体的化学式为?。
(3)Cu、Cu2O和CuO组成的混合物,加入100mL 0.6mol/L HNO3溶液恰好使混合物完全溶解,同时收集到224mL NO气体(标准状况)。如原混合物中Cu的物质的量为X,求其中Cu2O、CuO的物质的量及X的取值范围(写出解题过程)。
参考答案:(1)5∶1
(2)①NO、NO2,(1分) 11∶3 (2分)
②Cu(NO3)2·3H2O(2分)
(3)n(Cu2O)=(0.015-x) mol (2分)
n(CuO)= (x-0.005) mol(2分)? 0.005<x<0.015?(1分)
本题解析:(1)设单质铜与氧化亚铜的物质的量分别为x和y,则根据铜原子守恒可知x+2y= =0.105mol。又因为64g/mol×x+144g/mol×y=6.96g,解得x=0.075mol、y=0.015mol,因此单质铜与氧化亚铜的物质的量之比为5∶1。
=0.105mol。又因为64g/mol×x+144g/mol×y=6.96g,解得x=0.075mol、y=0.015mol,因此单质铜与氧化亚铜的物质的量之比为5∶1。
(2)①反应中转移电子的物质的量为0.075mol×2+0.015mol×2×1=0.18mol,气体的物质的量是1.568L÷22.4L/mol=0.07mol。设混合气中NO和NO2的物质的量分别为a mol和b mol,则a+b=0.07、3a+b=0.18,解得a=0.055mol、b=0.015mol,因此混合气的成分是NO和NO2,其体积之比为11∶3。
②设晶体的化学式为Cu(NO3)2·nH2O,则根据铜离子守恒可知晶体中铜离子的物质的量为0.105mol×80%=0.084mol,因此晶体的物质的量也是0.084mol,则0.084mol×(192+18n)g/mol=20.328g,解得n=3,即晶体化学式为Cu(NO3)2·3H2O。
(3)设Cu2O、CuO的物质的量分别为Ymol、Zmol,则根据铜原子守恒可知生成硝酸铜的物质的量为(X+2Y+Z)mol。NO的物质的量是0.01mol,则根据电子得失守恒可知2X+2Y=0.01×3=0.03。硝酸的物质的量是0.06mol,则根据氮原子守恒可知2×(X+2Y+Z)+0.01=0.06,解得Z=(x-0.005),Y=(0.015-x)。由于Y、Z均不能为0,作为X的取值范围是0.005<x<0.015。
本题难度:一般
5、选择题 将a g纯铜片投入足量的一定浓度的硝酸溶液中,反应中消耗的HNO3为b g.若a∶b=8∶21,则反应中起酸性作用的硝酸的质量为( )。
参考答案:D
本题解析:ag铜是a/64mol,则生成硝酸铜是a/64mol,所以反应中起酸性作用的硝酸的质量是a/64mol×2×63g/mol=63a/32g。又因为a∶b=8∶21,63a/32g=3b/4g,答案选D。
本题难度:一般