微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 a mol FeS与b mol FeO投入到V L、c mol·L-1的稀硝酸溶液中充分反应,产生NO气体,所得澄清溶液的成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为( )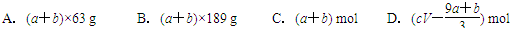
参考答案:BD
本题解析:Fe2+-------Fe3+↑e-×(a+b)? Fe(NO3)3------Fe---------3HNO3
S2---------S+6 ↑e-×8a?(a+b) mol ?3 (a+b) mol
NO3- ?---------NO↑3e-×X
由电子守恒得(a+b)+8a=3x? x=(9a+b)/3
本题难度:简单
2、计算题 有45.45 g KClO3和MnO2的混合物,加热一段时间后,质量变为40.65 g.将此剩余固体平均分成两份。?
(1)一份加足量的水溶解后,过滤,在滤液中加足量的硝酸酸化了的AgNO3溶液,可得沉淀多少克??
(2)另一份加入足量的浓盐酸,加热使之反应.将放出的气体通入含KI、KBr的1 L混合溶液,恰好使溶液中Br-、I-完全反应.若KI的物质的量浓度与KBr的物质的量浓度相等,都为0.35 mol·L-1,试求KClO3的分解百分率。
参考答案:
(1)7.175 g? (2)33%?
本题解析:
差量法是化学计算中的常用方法之一。减轻的质量即为生成的氧气的质量。据此可计算出生成的KCl质量,即求出AgCl沉淀的量。?
(1)混合物加热后质量减轻45.45-40.65=4.8 g,即生成O2的质量为4.8 g,混合物的一半可产生2.4 g O2。?
设分解了KClO3 x mol,生成KCly mol,生成沉淀z g。
2KClO3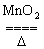 2KCl?+3O2↑
2KCl?+3O2↑
2 mol? 2 mol? 96 g?
x mol?y mol? 2.4 g
x=y=0.05?
KCl+AgNO3= AgCl↓+KNO3?
1 mol? 143.5 g?
0.05 mol? z mol
z=7.175 g?
(2)由于KBr、KI的物质的量均为:0.35 mol·L-1×1 L=0.35 mol
Cl2?+? 2KBr = 2KCl+Br2?
1? 2?
n(Cl2)? 0.35
n(Cl2)=0.175 mol?
即另一半固体混合物与浓盐酸反应,共放出0.35 mol Cl2?
6HCl+KClO3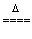 KCl+3Cl2↑+3H2O?
KCl+3Cl2↑+3H2O?
122.5 g? 3 mol?
m g?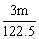 ?mol
?mol
4HCl+MnO2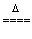 MnCl2+Cl2↑+2H2O?
MnCl2+Cl2↑+2H2O?
87 g? 1 mol?
w g?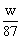 ?mol
?mol
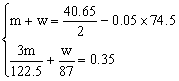
解得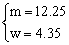 ?则KClO3的分解率=
?则KClO3的分解率=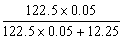 ×100%=33%.
×100%=33%.
本题难度:简单
3、填空题 金属材料是我们使用最广泛的一种材料,从古代到现代,金属材料经历了几次较大的变革。请回答下列问题。
(1)下面表格中铁和铜的某些物理性质摘自某化学手册。
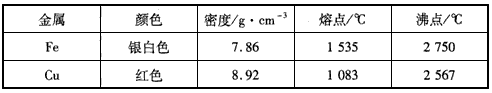
由上表可推知,人类最早使用的金属材料是____,请你写出做出上述判断的理由______。
(2)考古中出土的青铜器、铁剑等往往锈迹斑斑。请完成下面铜、铁制品在自然条件下发生锈蚀的化学方程式。
①___Cu+___O2+___H2O+___CO2=___Cu2(OH)2CO3
②___Fe+___O2+___H2O=___Fe2O3·nH2O
(3)镁、铝是现在常用的金属材料,这些活泼金属的冶炼方法不是采用火法炼制,而是采用___法, 工业生产中,镁的冶炼中反应物采用的是__,铝的冶炼中反应物采用的是___。
参考答案:(1)铜;铜的熔点低于铁的熔点
(2)①2 1 1 1 1;②4 3 2n 2
(3)电解;熔融氯化镁(或“MgCl2”);熔融氧化铝(或“Al2O3”)
本题解析:
本题难度:一般
4、填空题 (16分)连二亚硫酸钠(Na2S2O4),又称保险粉,是印刷工业中重要的还原剂。某课题小组进行如下实验:
I.【查阅资料】
(1)连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇。
(2)2Na2S2O4+4HCl= 4NaCl+S↓+3SO2↑+2H2O;Na2S2O3+2HCl= 2NaCl+S↓+SO2↑+H2O。
II.【制备方法】
75℃时将甲酸钠和纯碱加入乙醇水溶液中,通入SO2进行反应,完成其反应方程式:

冷却至40~50℃,过滤,用 洗涤,干燥制得Na2S2O4。
III.【Na2S2O4的性质】
(1)Na2S2O4溶液在空气中易被氧化.课题小组测定0.050mol/L
Na2S2O4溶液在空气中pH变化如图所示:0~t1段主要先生成HSO3-,根据pH变化图,HSO3-的电离程度 水解程度(填“<”或“>”)。
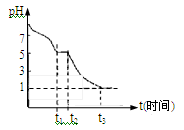
课题小组推测Na2S2O4溶液在空气中易被氧化,0~t1段发生离子反应方程式为 。t3时溶液中主要阴离子符号是 。
(2)隔绝空气加热Na2S2O4固体完全分解,得到固体产物Na2SO3、Na2S2O3和气体为 (填化学式).
请你设计实验验证产物有Na2S2O3存在,完成下表中内容。
(供选择的试剂:稀盐酸、稀硝酸、BaCl2溶液、KMnO4溶液)
实验步骤(不要求写出具体操作过程)
| 预期的实验现象和结论
|
|
|
参考答案:(16分,每空2分) II.2HCOONa+Na2CO3+4SO2= 2Na2S2O4+3CO2+H2O 乙醇
III.(1) > 2S2O42-+O2+2H2O=4HSO3- SO42-(或HSO4-) (2) SO2
实验步骤(不要求写出具体操作过程)
预期的实验现象和结论
取少量完全分解的固体产物于试管中,加入稀盐酸(2分)
若有淡黄色沉淀,则有Na2S2O3存在(2分)
本题解析:II.反应中S元素的化合价从+4价降低到+3价,得到1个电子。甲酸钠中碳元素的化合价从+2价升高到+4价,则根据电子得失守恒和原子守恒可知反应的化学方程式为2HCOONa+Na2CO3+4SO2= 2Na2S2O4+3CO2+H2O。连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇,因此可以用乙醇洗涤产品。
III.(1)0~t1段主要先生成HSO3-,根据图像可知溶液显酸性,这说明HSO3-的电离程度大于水解程度。
Na2S2O4溶液在空气中易被氧化生成亚硫酸氢钠,则0~t1段发生离子反应方程式为2S2O42-+O2+2H2O=4HSO3-。t3时溶液的pH=1,说明溶液的酸性较强,因此亚硫酸氢钠被氧化为硫酸氢钠,则溶液中主要阴离子符号是SO42-。
(2)隔绝空气加热Na2S2O4固体完全分解,得到固体产物Na2SO3、Na2S2O3和气体,其中亚硫酸钠是氧化产物,而Na2S2O3中S是+2价,则根据氧化还原反应中电子得失守恒可知气体应该是SO2。根据反应Na2S2O3+2HCl= 2NaCl+S↓+SO2↑+H2O可知要检验硫代硫酸钠,则只需要取少量完全分解的固体产物于试管中,加入稀盐酸,如果有淡黄色沉淀,则有Na2S2O3存在。
考点:考查氧化还原反应、水解反应、物质制备和检验实验设计与探究
本题难度:困难
5、选择题 二氧化氯(ClO2)是一种具有和氯气相似的刺激性气味的气体,沸点为11℃,常温下在水中的溶解度为2.9g/L。它是一种更安全的高效消毒剂,现在已普遍用它替代氯气对自来水进行消毒。下列关于二氧化氯的说法中错误的是
A.二氧化氯的氧化能力比氯气强,在消毒水中比氯气更安全高效
B.二氧化氯的摩尔质量为6
 7.5
7.5
C.二氧化氯具有消毒性能是因为它具有很强的氧化性
D.二氧化氯中氯元素的化合价为 +4价
+4价
参考答案:B
本题解析:略
本题难度:简单