微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)设反应①Fe(s)+CO2(g)  FeO(s)+CO(g)的平衡常数为K1。
FeO(s)+CO(g)的平衡常数为K1。
反应②Fe(s)+H2O(g)  ?FeO(s)+H2(g)的平衡常数为K2,在不同温度下,?K1、K2的值如下:
?FeO(s)+H2(g)的平衡常数为K2,在不同温度下,?K1、K2的值如下:
T(K)
| K1
| K2
|
973
| 1.47
| 2.36
|
1173
| 2.15
| 1.67
|
?
(1)平衡常数K1的表达式为?________________ ??。
(2)现有反应③ CO2(g) +H2(g)  ?CO(g) +H2O(g);△H>0,这是一个??(填“吸”或“放”)?热反应,要使反应③在一定条件下建立的平衡向右移动,可采取的措施的有??。
?CO(g) +H2O(g);△H>0,这是一个??(填“吸”或“放”)?热反应,要使反应③在一定条件下建立的平衡向右移动,可采取的措施的有??。
A.缩小反应容器容积? B.扩大反应容器容积? C.降低温度
D.升高温度? E.使用合适的催化剂? F.设法减少CO的量
(3)若反应Fe(s)+CO2(g)  ?FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)
?FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)  ?FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(CO)(其他条件均相同),则两者的反应速率?(填序号)。
?FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(CO)(其他条件均相同),则两者的反应速率?(填序号)。
A.前者大? B.后者大? C.一样大? D.无法判断
(4)以下图像:(图中v为速率,φ为生成物的百分含量,T为温度)
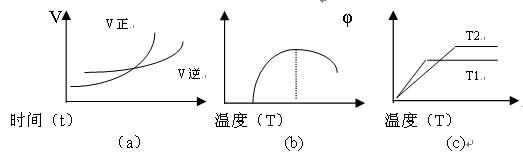
其中符合反应①的是? _________?(填图像序号,下同),符合反应②的是? ___??。
参考答案:
(1)K1=c(CO)/c(CO2) (2分)?(2)吸热(2分) D、F(2分)?(3)D (1分)(4)a(1分);b 、c(2分)
本题解析:略
本题难度:简单
2、选择题 相同温度下,体积均为0. 25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始时的有关数据如表所示:
2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始时的有关数据如表所示:
容器
编号
| 起始时各物质的物质的量/mol
| 达到平衡时体
系能量的变化
|
N2
| H2
| NH3
|
①
| 1
| 3
| 0
| 放出热量:23.15 kJ
|
②
| 0.9
| 2.7
| 0.2
| 放出热量:Q
|
?
下列叙述错误的是( )
A.容器①②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为
C.容器②中达到平衡时放出的热量Q=23.15 kJ
D.若容器①体积为0.5 L,则平衡时放出的热量小于23.15 kJ
参考答案:C
本题解析:对于给定反应,平衡常数只是温度的函数,温度相同,平衡常数相同,A正确。由①中放出的热量,可知参加反应的N2为0.25 mol,则有
? N2(g)+3H2(g) 2NH3(g)
2NH3(g)
n(始)/mol 1 3 0
n(变)/mol? 0.25? 0.75? 0.5
n(平)/mol? 0.75? 2.25? 0.5
则①中NH3的体积分数为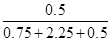 =
= ,由于①和②中建立的平衡是相同的,所以两容器中NH3的体积分数均为
,由于①和②中建立的平衡是相同的,所以两容器中NH3的体积分数均为 ,B正确。①和②建立的是相同的平衡,②中N2转化0.15 mol,放出的热量为92.6 kJ/mol×0.15 mol=13.89 kJ,C不正确。若容器①体积为0.5 L,即反应体积增大,压强减小,平衡向逆反应方向移动,则平衡时放出的热量小于23.15 kJ,D正确。
,B正确。①和②建立的是相同的平衡,②中N2转化0.15 mol,放出的热量为92.6 kJ/mol×0.15 mol=13.89 kJ,C不正确。若容器①体积为0.5 L,即反应体积增大,压强减小,平衡向逆反应方向移动,则平衡时放出的热量小于23.15 kJ,D正确。
本题难度:一般
3、选择题 在-50℃时,液氨的电离跟水的电离相似,存在平衡,2NH3(l) NH4++NH2—,NH4+的平衡浓度为1×10-15mol·L-1,下列说法错误的是( )
NH4++NH2—,NH4+的平衡浓度为1×10-15mol·L-1,下列说法错误的是( )
A.在液氨中加入NaNH2,可使液氨的离子积变大
B.在液氨中加入NH4Cl,液氨的离子积不变
C.此温度下液氨的离子积K为1×10-30
D.在液氨中加入金属钠可能有NaNH2生成
参考答案:A
本题解析:仔细观察液氨的电离方程式,不难发现液氨的电离类似于水的电离,均属于“质子(H+)转移自电离”, 其中NH4+和NH2-分别相当于纯水中水电离出的H3O+和OH-。由此类比推出,液氨的性质应类似于水,如液氨可以与金属钠反应生成H2和NaNH2;影响液氨电离平衡的因素也类似于水。液氨的离子积(也应该只是温度的函数)为常数,此温度下会恒等于1×10-30。故选项A不正确,BCD正确,答案选A。
点评:本题考查弱电解质的电离,难度适中,考查学生对已有知识的迁移,应用知识的能力。
本题难度:简单
4、选择题 如图表示不同温度(T)和压强(p)对可逆反应2L(g) 2M+2N(g)(吸热反应)的影响,且p2>p1。则图中纵轴表示的意义可能是(?)
2M+2N(g)(吸热反应)的影响,且p2>p1。则图中纵轴表示的意义可能是(?)
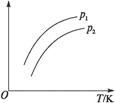
①一定条件下L的转化率②混合气体中M的百分含量③混合气体中L的百分含量④混合气体的平均摩尔质量
A.①②
B.①③
C.②④
D.②
参考答案:A
本题解析:增大压强平衡向左移动,①②符合题意;③④错误,因为都增大。
本题难度:一般
5、选择题 可逆反应2SO2+O2?

?2SO3在密闭容器中达到了平衡,下列说法正确的是( )
A.SO2和O2不再化合,反应停止了
B.容器内压强保持不变
C.SO2、O2和SO3的浓度相等
D.SO2、O2和SO3的物质的量之比为2:1:2
参考答案:A、化学平衡是动态平衡,当反应达到平衡状态时,正逆反应速率相等,但不为0,故A错误;
B、随着反应的进行体系压强逐渐减小,容器内压强保持不变说明达平衡状态,故B正确;
C、当体系达平衡状态时,SO、O2和SO3的浓度可能相等,也可能不等,与各物质的初始浓度及转化率有关,故C错误;
D、当体系达平衡状态时,SO、O2和SO3的物质的量之比可能为2:1:2,也可能不是2:1:2,与各物质的初始浓度及转化率有关,故D错误;
故选B.
本题解析:
本题难度:简单