| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点归纳《化学平衡状态的判断》考点预测(2017年强化版)(二)
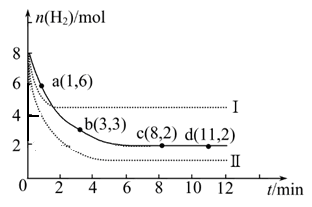 ① a点正反应速率 逆反应速率(填“大于”、“等于”或“小于”)。 ② 仅改变某一实验条件时,测得H2的物质的量随时间变化如图中虚线所示,曲线Ⅰ对应的实验条件改变是 ?,曲线Ⅱ对应的实验条件改变是 ? ? 。 ③ 在题给图中绘出加入催化剂对应的曲线。 ④ 结合图给实线的数据,计算该温度时反应的化学平衡常数。(写出计算过程) (3)甲醇可用以制燃料电池,常用KOH作电解质溶液,负极的电极反应式为:?。 参考答案:(16分) 本题解析:(1)各组分变化的物质的量之比等于化学方程式中的系数之比,平衡时物质的量之比不一定等于系数之比,故A选项错误;正反应是气体物质的量减小的方向,因此从正反应开始进行时,容器内气体物质的量逐渐减小,压强逐渐减小,若压强保持不变,说明气体总的物质的量保持不变,反应已达平衡,故B选项正确;氢气是反应物,其消耗速率为v正(H2),甲醇是生成物,其消耗速率为v逆(CH3OH),二者之比等于化学方程式中相应的系数之比,说明反应已达平衡,故C选项正确;各组分都是气体,则容器内气体的总质量和容器的体积都保持不变,因此容器内气体的密度始终不变,不能说明反应已达平衡,故D选项错误;(2)①氢气是反应物,从正反应开始进行时,其物质的量逐渐减小,a点表示氢气的物质的量还没有达到极限,还能继续减小,说明此时反应还在向正反应方向进行,所以v正(H2)> v逆(H2);②读图可得,曲线I先达到平衡,且平衡时氢气的物质的量比原平衡大,说明采取的条件既能增大反应速率,又能使平衡向逆反应方向移动,根据外界条件对反应速率和平衡移动的影响规律推断,只有升高温度才能得到曲线I,因为正反应是放热反应;只有增大压强才能得到曲线II,因为正反应是气体体积减小的方向;③无催化剂变为有催化剂,只能加快反应速率,缩短达到平衡的时间,不能使平衡移动,不能改变氢气起始时和平衡时的物质的量,由此可以画出加入催化剂时氢气的物质的量随反应时间变化的示意图,并作出必要的标注;④用三行数据法和定义式求平衡常数,则: 本题难度:困难 5、填空题 I.高炉炼铁的主要反应为Fe2O3+3CO2Fe+3CO2。 |
 FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g) FeO(s)+H2(g),其平衡常数K2.在温度973K和1173K情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其平衡常数K2.在温度973K和1173K情况下,K1、K2的值分别如下:| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
参考答案:(14分)
(1)0.006?(2分)
(2)60%?(2分)
(3)D?(2分)
(4)>?(2分)
(5) ?(2分)
?(2分)
(6)K3=K1/K2?(2分) >?(2分)
本题解析:I.⑴在1000℃时,该反应的平衡常数K=64,在10L恒容密闭容器甲中,加入物质反应达到平衡,设消耗一氧化碳物质的量为x
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
起始量(mol) 1? 1? 1? 1
变化量(mol)? x? x
平衡量(mol)? 1-x? 1+x
K=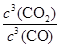 =
= =64,计算得到x=0.6
=64,计算得到x=0.6
转化率=60%
v(CO2)= =0.006mol/L
=0.006mol/L min
min
故答案为:⑴0.006mol/L min⑵60%;
min⑵60%;
⑶A.铁是固体,减少Fe的量,不影响平衡移动,CO的平衡转化率不变,故A错误;
B.氧化铁是固体,增加Fe2O3的量,不影响平衡移动,CO的平衡转化率不变,故B错误;
C.该反应正反应是放热反应,提高反应温度,平衡向逆反应移动,CO的平衡转化率降低,故C错误;
D.移出部分CO2,平衡向正反应移动,CO的平衡转化率增大,故D正确;
E.加入合适的催化剂,平衡不移动,故E错误;
F.反应前后气体的物质的量不变,减小容器的容积,增大压强平衡不移动,CO的平衡转化率不变,故F错误;
故选D;
⑷由表中数据可知,温度升高,①的平衡常数增大,说明平衡向正反应方向移动,则正反应吸热,△H?>0
故答案为:>;
⑸依据反应CO2(g)+H2(g) CO(g)+H2O(g),根据平衡常数的概念,该反应的平衡常数K3的数学表达式:K=
CO(g)+H2O(g),根据平衡常数的概念,该反应的平衡常数K3的数学表达式:K=
,故答案为:
(6)已知:①Fe(s)+CO2(g) FeO(s)+CO(g);
FeO(s)+CO(g);
②Fe(s)+H2O(g) FeO(s)+H2(g);
FeO(s)+H2(g);
利用盖斯定律将①-②可得:③H2(g)+CO2(g) CO(g)+H2O(g);
CO(g)+H2O(g);
则K3= =
=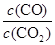 ÷
÷ =
=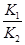 ;
;
依据图表平衡常数数据分析,温度升高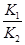 增大,说明平衡正向进行,反应是吸热反应;△H>0,
增大,说明平衡正向进行,反应是吸热反应;△H>0,
答案: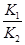 ,>。
,>。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学试题《阿伏伽德罗常数》.. | |