微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 Cs是ⅠA族元素,F是ⅦA族元素,估计Cs和F形成的化合物可能是
A.离子化合物
B.化学式为CsF2
C.共价化合物
D.室温为气体
参考答案:A
本题解析:Cs是ⅠA族元素容易失去一个电子形成阳离子,F是ⅦA族元素,容易得到一个电子形成阴离子,故Cs和F形成的应为离子化合物,化学式为CsF,它在室温时以固体形式存在,形成离子晶体。
本题难度:简单
2、填空题 (12分) Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
Q、R、X、Y、Z五种元素的原子序数依次递增。已知: ①Z的原子序数为29,其余的均为短周期主族元素;
①Z的原子序数为29,其余的均为短周期主族元素; ②Y原子价电子(外围电子)排布msnmpn?
②Y原子价电子(外围电子)排布msnmpn? ③R原子核外L层电子数为奇数;
③R原子核外L层电子数为奇数; ④Q、X原子p轨道的电子数分别为2和4。
④Q、X原子p轨道的电子数分别为2和4。
 请回答下列问题:
请回答下列问题:
 (1)基态原子Z的电子排布式是?。
(1)基态原子Z的电子排布式是?。
 (2)在[Z(NH3)4]2+离子中, NH3提供?。
(2)在[Z(NH3)4]2+离子中, NH3提供?。
 (3)QX2的电子式?,一种由X和R组成的化合物与QX2互为等电子体,其化学式为?。
(3)QX2的电子式?,一种由X和R组成的化合物与QX2互为等电子体,其化学式为?。
(4) 比较X的氢化物与同主族相邻元素所形成的氢化物稳定性?,(填化学式),并说明理由?。
比较X的氢化物与同主族相邻元素所形成的氢化物稳定性?,(填化学式),并说明理由?。
参考答案:(1)? 1s22s22p63s23p63d104s1?。
 (2)?孤电子对?。
(2)?孤电子对?。
 (3)?
(3)?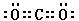 ?,? N2O?。
?,? N2O?。
(4) ? H2O>H2S?键长越短,键能越大,化合物越稳定?
? H2O>H2S?键长越短,键能越大,化合物越稳定?
本题解析:略
本题难度:一般
3、选择题 向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液.下列对此现象说法正确的是(?)
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4] 2+
C.向反应后的溶液加入乙醇,溶液没有发生变化
D.在[Cu(NH3)4] 2+离子中,Cu2+给出孤对电子,NH3提供空轨道
参考答案:B
本题解析:开始生成的难溶物是氢氧化铜沉淀。由于氢氧化铜能和氨水反应生成配合物,其中氨气是配体,提供孤对电子,而铜离子提供空高低,接受孤对电子,A和D不正确,B正确。该配合物能溶于乙醇中,C不正确,所以正确的答案选B。
点评:该题是中等难度的试题,试题基础性强,侧重能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力,有助于调动学生的学习兴趣和学习积极性。
本题难度:一般
4、填空题 (1)现有A、B、C、D、E五种原子序数递增的主族元素,A的原子核中没有中子;B、D元素处于同一周期,D的原子半径较小,B、D的质子数之和为27,质子数之差为5;C的单质跟盐酸反应,生成C3+和氢气;E和D能形成E2D型离子化合物,且E、D两元素的简单离子具有相同电子层结构.
①写出元素符号:A______,D______,E______.
②B、C的最高价氧化物对应水化物相互反应的离子方程式为:______.
③写出A2D的电离方程式:______,______.
(2)元素在周期表中的位置,反映了元素的原子结构和元素的性质.N、P、AS;O、S、Se分别是VA族、VIA族连续三元素.
①根据元素周期律,预测:酸性强弱H3AsO4______H3PO4.(用“>”或“<”表示)
②元素S的最高正价和最低负价的代数和为______,在一定条件下,S与H2反应有一定限度,请判断:在相同条件下Se与H2反应的限度比S与H2反应限度______.(选填“更大”、“更小”或“相同”)
③将SO2气体通入溴水恰好完全反应后,溶液中存在的离子浓度由大到小的顺序是______.
参考答案:(1)A、B、C、D、E五种原子序数递增的主族元素,A的原子核中没有中子,则A为氢元素;B、D元素处于同一周期,D的原子半径较小,B、D的质子数之和为27,质子数之差为5,则B为Na、D为S元素;C的单质跟盐酸反应,生成C3+和氢气,则C为Al;E和D能形成E2D型离子化合物,E表现+1价,且E、D两元素的简单离子具有相同电子层结构,则E为K元素,
①由上述分析可知,A为H,D为S,E为K,故答案为:H;S;K;
②B、C的最高价氧化物对应水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水,反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
③H2S是弱电解质,分步电离,电离方程式为:H2S?HS-+H+、HS-?H++S2-,
故答案为:H2S?HS-+H+、HS-?H++S2-;
(2)①P和As同主族,电子层增多,非金属性As<P,非金属性越强,最高价氧化物对应水化物的酸性越强,故酸性H3AsO4<H3PO4,
故答案为:<;
②S位于第ⅥA族,最高价为+6价,最低价为6-8=-2价,故其最高正价和最低负价的代数和=+6-2=4;同主族,从上到下非金属性减弱,与氢气化合越难,在相同条件下Se与H2反应的限度比S与H2反应限度更小,
故答案为:4;小;
③将SO2气体通入溴水中发生反应:SO2+Br2+H2O=2HBr+H2SO4,由于恰好完全反应,为HBr与硫酸混合溶液,二者物质的量浓度之比为2:1,HBr与硫酸都是强电解质,完全电离,溶液呈酸性,故溶液中c(H+)>c(Br+)>c(SO42-)>c(OH-),
故答案为:c(H+)>c(Br+)>c(SO42-)>c(OH-).
本题解析:
本题难度:一般
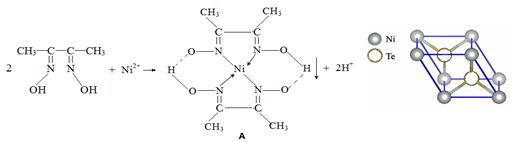
5、填空题 一定条件下, Ni2+与丁二酮肟生成鲜红色沉淀A。
(1)基态Ni原子的价层电子排布式为?。
(2)丁二酮肟组成元素中C、N、O的第一电离能由小到大的顺序为?。
丁二酮肟分子中C原子轨道的杂化类型是?。
(3)元素Ni的一种碲(Te)化物晶体的晶胞结构如图所示,则该化合物的化学式为?。
(4)Ni(CO)4是一种无色液体,沸点为42.1℃,熔点为-19.3℃。Ni(CO)4的晶体类型是?。请写出一种由第二周期主族元素组成的且与CO互为等电子体的阴离子的电子式?。
参考答案:(1)3d84s2?(2分)?(2)C<O<N (2分) sp3和sp2(2分)(3)NiTe2(2分)
(4)分子晶体 (2分)?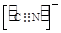 或
或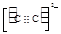 (2分,其它合理也得分)
(2分,其它合理也得分)
本题解析:(1)Ni为28号元素,所以基态Ni原子的价层电子排布式为:3d84s2?
(2)N原子2p轨道电子数为3,正好为半充满状态,处于稳定状态,失电子较难,所以C、N、O的第一电离能由小到大的顺序为:C<O<N;丁二酮肟中-CH3中C原子为sp2杂化,C=N中C原子形成两个碳碳单键和一个碳氮双键,为sp3杂化,所以丁二酮肟分子中C原子轨道的杂化类型是sp3和sp2
(3)根据均摊法,Ni位于晶胞的顶点,含Ni数目为:8×1/8=1,Te位于晶胞内部,数目为2,所以该化合物的化学式为NiTe2
(4)Ni(CO)4是一种无色液体,沸点为42.1℃,熔点为-19.3℃,熔沸点低,所以为分子晶体;原子数目和价电子数相等的微粒互为等电子体,所以与CO互为等电子体的阴离子为CN-或C22-,电子式分别为: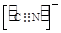 或
或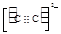 。
。
本题难度:一般