微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 单质铜及其化合物一般都具有特殊的颜色,如
Cu
| Cu2O
| CuO
| Cu(OH)2
| CuSO4·5H2O
|
红色(或紫红色)
| 红色(或砖红色)
| 黑色
| 蓝色
| 蓝色
|
?
某学校学习小组甲为检测实验室用H2还原CuO所得红色固体中是否含有Cu2O,进行了认真的研究。
Ⅰ.查阅资料得出下列信息:
①Cu2O属于碱性氧化物;
②高温灼烧CuO生成Cu2O;
③Cu2O在酸性条件下能发生反应:Cu2O+2H+=Cu+Cu2++H2O。
Ⅱ.设计实验方案:
方案1:取该红色固体溶于足量的稀硝酸中,观察溶液颜色变化。
方案2:取该红色固体溶于足量的稀硫酸中,观察溶液是否呈蓝色。
方案3:称得干燥坩埚的质量为a g,取红色固体置于坩埚中称得总质量为b g,在空气中高温灼烧至质量恒定,称得最后总质量为c g。
(1)写出Cu2O与稀硝酸反应的化学方程式:_______________________。
(2)请你评价方案1和方案2的合理性,并简述理由:
方案1:_______________________。
方案2:_______________________。
(3)方案3中,若确认红色固体中含有Cu2O,则a、b、c的关系为________,在该实验方案中最少应进行________次称量。
Ⅲ.学习小组乙设计了新的探究方案,拟根据干燥管中无水硫酸铜是否变蓝判断红色固体中是否含有Cu2O,装置如图所示。
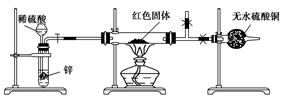
(4)该探究方案中检验气体发生装置气密性的方法为________(说明操作方法、现象和结论)。
(5)为确保探究的科学、合理和安全,你认为实验中还应采取的措施有____(填序号)。
A.在氢气发生装置与硬质玻璃管之间增加一个干燥装置
B.加热前先排尽装置中的空气
C.在盛有无水硫酸铜的干燥管后再连接一个装有碱石灰的干燥管
参考答案:(1)3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O
(2)不合理,因为铜和氧化亚铜均可溶于稀硝酸形成蓝色溶液
合理,因为氧化亚铜可与稀硫酸反应生成Cu和Cu2+,导致溶液呈蓝色
(3)8c<9b-a 4
(4)关闭导气管上的活塞,从分液漏斗往试管中注水,使漏斗中的液面高于试管中的液面,静置一段时间后液面差不变,说明气体发生装置气密性良好
(5)ABC
本题解析:该题实际上给出了四种方案,方案1中因硝酸具有氧化性,所以无法区分溶液中的Cu2+是来自于Cu还是Cu2O;方案2中因稀硫酸无强氧化性,所以通过观察溶液是否显蓝色可以判断红色固体中是否含有Cu2O;方案3是通过定量分析的方法来进行判断的,原理是4Cu+O2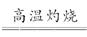 ,2Cu2O,若(b-a)g红色固体全部是Cu,则Cu2O的质量为
,2Cu2O,若(b-a)g红色固体全部是Cu,则Cu2O的质量为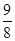 (b-a)g,若红色固体中含有Cu2O,则
(b-a)g,若红色固体中含有Cu2O,则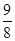 (b-a)g>(c-a)g,即8c<9b-a。(5)学习小组乙的探究方案存在一定的弊端,如没有设计干燥装置。制取的H2中含水蒸气,空气中也有水蒸气,都能使无水硫酸铜变蓝色。
(b-a)g>(c-a)g,即8c<9b-a。(5)学习小组乙的探究方案存在一定的弊端,如没有设计干燥装置。制取的H2中含水蒸气,空气中也有水蒸气,都能使无水硫酸铜变蓝色。
本题难度:困难
2、实验题 (16分)某学习小组以 溶液作试剂,设计提纯含有少量
溶液作试剂,设计提纯含有少量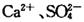 的粗盐。其实验方案如下:
的粗盐。其实验方案如下:
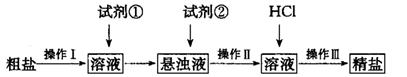
(1) 操作I的名称为________;试剂①应选用_______;检验试剂②是否过量的方法______。
(2) 操作I?III共用到玻璃棒________次;从悬浊液到精盐的实验过程中,某同学未按上述方案进行,最终导致精盐纯度偏低。其做法可能是________________。
(3)测定产品精盐中NaCl的含量的实验步骤是:
第一步:准确称取a g干燥精盐于锥形瓶中,加人30. OmL蒸馏水。
第二步:向上述锥形瓶中加人几滴突光素指示剂。
第三步:用浓度为的AgNO3标液滴至终点(溶液呈浅红色),消耗AgNO3溶液V mL。
①盛装干燥精盐的烧杯应放在________中保存(填仪器名称);
②终点时溶液呈浅红色是荧光素指示剂与________反应(填“Ag+”或"NO3-”);
③某同学在第二次滴定时,滴定前,后管内液面分别如图,则其所得V=________mL;

④NaCl的质量分数为________ (用字母表示)
参考答案:(1)除去;BaCl2溶液;静止悬浊液,取适量的的上层清液于试管中,滴入适量碳酸钠溶液,若不出现混浊则试剂②已经过量,反之则不过量。
(2)3;将过滤与加盐酸顺序颠倒或盐酸用量不足或蒸发时尚有大量水未蒸干
(3)干燥器;Ag+;19.10;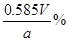
本题解析:除Ca2+和SO42-分别需要碳酸钠和氯化钡,但过量的氯化钡还需要碳酸钠来除去,因此在除去Ca2+前需要先除去SO42-,多余的碳酸钠可用盐酸来除去。但再加入盐酸之前要先过滤除去沉淀,然后才能加入盐酸。试剂②是碳酸钠溶液,若碳酸钠不过量,则继续加入会产生白色沉淀,所以检验其是否过量的方法为:静止悬浊液,取适量的的上层清液于试管中,滴入适量碳酸钠溶液,若不出现混浊则试剂②已经过量,反之则不过量;若所制取的精盐纯度偏低有可能是加盐酸前没有过滤,或盐酸量不足或蒸发时尚有大量水未蒸干;为了防止精盐吸水需要放在干燥器中。因为Ag+与Cl-结合生成了白色沉淀,而NO3-并没有参与反应,所以只有当Ag+过量是才能发生颜色的变红,因此荧光素指示剂与反应的Ag+。滴定前后的读数分别未2、30ml和21.40ml,所以V=19.10mL。消耗AgNO3的量是0.0001Vmol,所以氯化钠的质量是5.85V×10-3g,所以NaCl的质量分数为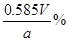 。
。
本题难度:一般
3、选择题 下列实验装置中能达到实验目的的是(? )
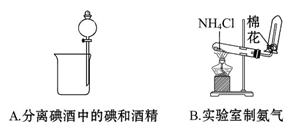
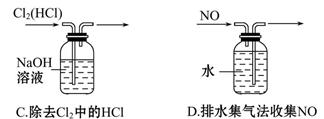
参考答案:D
本题解析:不能用分液法分离碘酒中的碘和酒精,因为二者互溶。NH4Cl受热分解,冷却后又重新生成NH4Cl,故很难收集到NH3。C项中Cl2和HCl均可与NaOH溶液反应,故不能用NaOH溶液除去Cl2中的HCl,而应采用饱和食盐水除去Cl2中的HCl
本题难度:一般
4、选择题 可以用来鉴别甲烷和乙烯,还可以用来除去甲烷中乙烯的操作方法是
[? ]
A.将混合气体通过盛有硫酸的洗气瓶
B.将混合气体通过盛有足量溴水的洗气瓶
C.将混合气体通过盛有水的洗气瓶
D.将混合气体通过盛有澄清石灰水的洗气瓶
参考答案:B
本题解析:
本题难度:一般
5、实验题 有一包白色固体粉末,可能由硫酸钠、硝酸钾、硝酸铵、碳酸钙、氯化钡、硫酸铜中的一种或几种组成,做实验得以下结果:
⑴将此固体粉末加到水中,得到白色沉淀和上层无色清液;
⑵过滤后,在滤出的白色沉淀里加入稀硝酸,白色沉淀部分溶解并有无色气体生成,该气体能使澄清石灰水变浑浊;
⑶在滤液中,加入适量的氢氧化钠溶液并加热,生成有刺激性气味的无色气体,该气体能使湿润的红色石蕊试纸变蓝。
由此实验推断:该粉末中一定含有_________________________________________;
一定不含有_______________________;可能含有____________________。(填化学式)
参考答案:一定含有:Na2SO4,BaCl2,CaCO3,NH4NO3;一定不含有:CuSO4;可能含有:KNO3。
本题解析:由题意知溶液无色。则推知不含CuSO4溶液,有白色沉淀产生,可以推知有本身不溶于水的CaCO3存在或能相互反应生成BaSO4的Na2SO4和BaCl2的存在,然后依据加入稀硝酸沉淀部分溶解,则可以推断两种沉淀均存在,又通过加入强碱产生有刺激性气味的其体可以推断含有NH4NO3,对于KNO3只能为可能含有。
本题难度:简单