微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)X原子在第二电子层上只有一个空轨道,则X是?;其轨道表示式为?;R原子的3p轨道上只有一个未成对电子,则R原子可能是?、?;Y原子的核电荷数为29,其电子排布式是?,其在元素周期表中的位置是?,是属于?区的元素。
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:_________、__________、________。
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子。
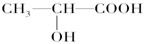
(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,属于非极性分子的是(填序号)________________。
(5) 试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4________H2SO3;? H3PO4________H3PO3。
(6)根据价层电子对互斥理论判断下列问题:
H2O中心原子的杂化方式为?杂化,分子的立体构型为?。
BF3分子中,中心原子的杂化方式为?杂化,分子的立体构型为?。
(7)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于___________________________。
参考答案:(1) C?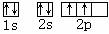 ?Al? Cl? 1s22s22p63s23p63d104s1?
?Al? Cl? 1s22s22p63s23p63d104s1?
第四周期ⅠA族? ds? 10分
(2)Co? CN? 63分
(3)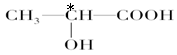 1分
1分
(4)①③④⑦ 2分
(5)>? >? 2分
(6)sp3? V形? sp2?平面三角形? 4分
(7)由于水分子中含有氢键2分
本题解析:(1)根据构造原理可知,若X原子在第二电子层上只有一个空轨道,则X是碳元素,起轨道表达式 ;R原子的3p轨道上只有一个未成对电子,则根据构造原理可知,R原子可能是Al和Cl;Y原子的核电荷数为29,所以Y是铜元素。根据构造原理可知,其电子排布式是1s22s22p63s23p63d104s1;铜元素位于第四周期ⅠA族;区的名称来自于按照构造原理最后填入电子的能级的符号,所以铜元素属于ds区。
;R原子的3p轨道上只有一个未成对电子,则根据构造原理可知,R原子可能是Al和Cl;Y原子的核电荷数为29,所以Y是铜元素。根据构造原理可知,其电子排布式是1s22s22p63s23p63d104s1;铜元素位于第四周期ⅠA族;区的名称来自于按照构造原理最后填入电子的能级的符号,所以铜元素属于ds区。
(2)考查配位键的形成与有关判断。根据化学式可知,CN提供孤对电子,所以CN是配体,配位数是6;钴离子接受孤对电子,属于中心离子。
(3)人们将连有四个不同基团的碳原子形象地称为手性碳原子(常以*标记手性碳原子),所以根据结构简式可知,手性碳原子是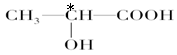 。
。
(4)原子间以共价键结合,分子里电荷分布均匀,正负电荷中心重合的分子,即分子中正负电荷中心重合,从整个分子来看,电荷分布是均匀的,对称的,这样的分子为非极性分子。CO2是直线型结构,四氯化碳是正四面体形结构,三氟化硼和三氧化硫都是平面正三角形结构,所以均属于非极性分子,其余都是极性分子,答案选①③④⑦。
(5)根据(HO)m(RO)n可知,n值越大,酸性越强。亚硫酸中n=1,硫酸中n=2,所以硫酸的酸性强于亚硫酸的;H3PO4中n=1,H3PO3中n=0,所以磷酸的酸性强于亚磷酸的。
(6)根据价层电子对互斥理论可知,水分子中氧原子含有的孤对电子对数是(6-1×2)÷2=2,所以水是V形结构,氧原子是sp3杂化;BF3分子中B原子含有的孤对电子对数是(3-1×3)÷2=0,所以三氟化硼是平面正三角形结构,B原子是sp2杂化。
(7)由于由于水分子中含有氢键,所以H2O的沸点(100℃)比H2S的沸点(-61℃)高。
本题难度:一般
2、填空题 (6分)原子序数大于4的主族元素A和B的离子Am+ 和Bn-它们的核外电子排布相同,据此推断:
①A和B所属周期数之差为______________,
② A和B的核电荷数之差为______________(用含m、n的代数式表示)
③ B和A的族序数之差为________________(用含m、n的代数式表示)
参考答案:(6分)①? 1?;②? m+n?;③? ?(每空2分)
?(每空2分)
本题解析:略
本题难度:一般
3、填空题 (12)某元素R原子的核外电子数等于核内中子数,该元素的单质2.8g与氧气充分反应,生成6.0g的化合物RO2。请回答:
(1)元素R的原子序数是?。
(2)元素R的原子共有?个电子层,能量最低的电子层中共有?个电子。
(3)写出元素R的最高价氧化物对应水化物的化学式?,它的酸性比碳酸的酸性?。
参考答案:(1)? 14?(2)3?(3)2?(4)H2SiO3?(5)弱
本题解析:有质量守恒定律得出参加反应的氧气质量为6 g—2.8 g="3.2" g,物质的量为3.2/32mol="0. 1" mol,所以产物RO2物质的量也为0.1 mol,则其摩尔质量为60 g/ mol,因而R的相对原子质量为60—32=28,即其质子数为14,此元素为硅元素,原子序数是14。
本题难度:一般
4、填空题 A、B、C、D 四种短周期元素,原子序数依次增大, A 原子的最外层上有 5 个电子; B 的阴离子和 C 的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体 E , D 的L 层电子数等于 K、M 两个电子层上的电子数之和。 ( 1 ) A 的最高价氧化物的水化物是___________(填化学式);
( 2 )物质 E 中所包含的化学键有______________,写出 C、D 两元素形成的化合物 C2D 的电子式______________________;
( 3 )把盛有 48mL AB、AB2混合气体的容器倒置于水中(同温、同压下),待液面稳定后,容器内气体体积变为 24 mL,则原混合气体中 AB 的体积分数为__________。
(每空 2 分,共 8 分)
参考答案:( l ) HNO3 , ( 2 )离子键、(非极性)共价键,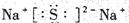 ,
,
( 3 ) 25 %
本题解析:A 的原子序数最小, A 原子的最外层上有 5 个电子,说明是 N ; E 是淡黄色的固体 Na2O2,则 B 是O, AB 和 AB2分别是 NO 和 NO2; D 的 L 层电子数等于 K、M 两个电子层上的电子数之和是 S ;设 NO 体积为x mL , NO2体积为y mL ,可列方程式:x + y= 48 , x + y =" 24" ,解得x= 12 。
本题难度:一般
5、填空题 A、B、R、D、E、F是六种原子序数依次增大的短周期元素, 其中有两种非金属元素位于同一主族。已知A、B、D均能与R形成原子(或离子)个数不同的几种常见化合物。请回答下列有关问题。
(1)仅由上述信息就可以确定的元素(写出代号与元素符号)是________________,若X、Y是D、F形成的最高价氧化物对应的水化物,浓度均为0.1mol/L的X、Y溶液的pH之和为14,则X、Y的晶体熔点相对高低为(写化学式)______?______
(2) A与B、E均可形成正四面体构型的气态分子Q、P,又知P的燃烧热为1430kJ/mol,则其燃烧的热化学方程式___________?_________
(3) 上述六种元素间能形成多种常见二元化合物,其中存在两类化学键的物质的电子式为_____?__(写一种即可)
(4) R能形成多种单质,如R2、R3,研究表明,新近制得的一种组成为R4的分子中,每个R原子均与另外两个R原子各形成一个键,下列有关R4的说法中正确的是__?_____
①R4与R3、R2互为同位素?②R4不能与A、B、D的单质反应
③R4中各原子最外电子层均为8电子结构?④R4是一种新型化合物
参考答案:(1)R:O,NaOH >HClO4;
(2)SiH4(g)+2O2(g)=SiO2(s)+2H2O(l);△H=-1430kJ/mol
(3) 过氧化钠的电子式? (4) ③
本题解析:略
本题难度:简单