微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)主族元素W、X、Y、Z的原子序数依次增大,W的原子最外层电子数是次外层电子数的3倍.X、Y和Z分属不同的周期,它们的原子序数之和是W原子序数的5倍.在由元素W、X、Y、Z组成的所有可能的二组分化合物中,由元素W与Y形成的化合物M的熔点最高.(提示:Y是第ⅡA族元素)请回答下列问题:
(1)W元素原子的L层电子排布式为________
(2)X单质与水发生主要反应的化学方程式为___________________
(3)化合物M的化学式为________,其晶体结构与NaCl相同,而熔点高于NaCl.M熔点较高的原因是________________________________________
(4)X、Y、Z可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角,Z处于体心位置,则该晶体的组成为X∶Y∶Z=________;
参考答案:) (1)2s22p4 (1分)?(2)2F2+2H2O===4HF+O2(2分)
(3)MgO(2分) 晶格能大(1分) (4)3∶1∶1(2分)
本题解析:考查原子核外电子的排布规律及晶体的有关应用。
W的原子最外层电子数是次外层电子数的3倍,则W是O。Y是第ⅡA族元素,且W与Y形成的化合物M的熔点最高,所以M是氧化镁,则Y是镁。W、X、Y、Z的原子序数依次增大,因此X是F。又因为X、Y和Z的原子序数之和是W原子序数的5倍,所以Z是K。
(1)根据构造原理可写出
(2)氟是最活泼的非金属,和水反应生成氟化氢和氧气。
(3)镁离子半径小于钠离子半径,氧离子半径小于氯离子半径,所以氧化镁中的晶格能要大于氯化钠中的,故熔点高。
(4)X占据所有棱的中心,则X的个数是12×1/4=3。 Y位于顶角,则Y的个数是8×1/8=1。Z处于体心位置,所以该晶体的组成为X∶Y∶Z=3∶1∶1。
本题难度:一般
2、填空题 下表为周期表的一部分,其中的编号代表对应的元素。

试填空。
(1)写出上表中元素I的基态原子的电子排布式和价层电子排布图:________________________________________________________________________。
元素C、D、E、F的第一电离能由大到小的顺序是________(用元素符号表示)。
(2)元素A分别与C、D、E形成最简单的常见化合物分子甲、乙和丙。下列有关叙述不正确的有________。
A.甲、乙和丙分子的空间构型分别为正四面体形、三角锥形、V形
B.甲、乙和丙分子中,中心原子均采取sp3的杂化方式
C.三种分子中键角由大到小的顺序是丙>乙>甲
D.甲、乙和丙分子均为由极性键构成的极性分子
(3)由元素J、C、E组成一种化学式为J(CE)5的配位化合物,该物质常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂。据此可判断:
①该化合物的晶体类型为________。
②该化合物的晶体中存在的作用力有________。
A.离子键?B.极性键
C.非极性键?D.范德华力
E.氢键? F.配位键
③根据共价键理论和等电子体理论分析,CE分子中σ键与π键的数目比为________。
(4)在测定A与F形成的化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是________________________________________________。
(5)某些不同族元素的性质也有一定的相似性,如表中元素G与元素B,原因是_____________________________________________________________。
参考答案:(1)1s22s22p63s23p63d54s1(或[Ar]3d54s1) 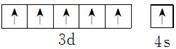 ?F>N>O>C
?F>N>O>C
(2)CD
(3)①分子晶体 ②BDF ③1∶2
(4)氟化氢气体中存在因氢键而相互缔合形成的缔合分子(HF)n
(5)Be与Al在元素周期表中位于对角线的位置
本题解析:根据这几种元素在周期表中的位置推知:A为H(氢),B为Be,C为C(碳),D为N,E为O,F为F(氟),G为Al,H为Cl,I为Cr,J为Fe,(1)Cr元素基态原子的电子排布式为1s22s22p63s23p63d54s1或[Ar]3d54s1,其价层电子排布图为 ,一般来说,同周期元素从左到右第一电离能逐渐增大,但N元素原子2p轨道上电子达到半充满,故其第一电离能要大于O的第一电离能,因此这四种元素的第一电离能由大到小的顺序为F(氟)>N>O>C(碳)。(2)甲、乙、丙分别为CH4、NH3、H2O,这三种分子的中心原子均采取sp3的杂化方式,它们的空间构型分别为正四面体形、三角锥形、V形,CH4分子中的键角为109°28′,而NH3分子和H2O分子上有未成键的孤电子对;孤对电子越多,排斥力越大,键角越小,所以键角顺序为H2O<NH3<CH4,故A项、B项正确,C项错误;这三种分子中,CH4为非极性分子,NH3、H2O均为极性分子,D项错误。(3)由该化合物的熔沸点可判断它为分子晶体,分子晶体中均存在范德华力,由该分子的结构可以看出其晶体中还存在极性键和配位键;CO分子和N2分子互为等电子体,故CO分子的结构与N2类似,为C≡O,因此CO分子中σ键和π键的个数比为1∶2。(4)A与F形成的化合物为HF,它的分子间存在的氢键会使HF相互结合形成(HF)n,从而使得测的相对分子质量偏高。(5)Be和Al在元素周期表中位于对角线的位置,因此它们的有些性质是相似的。
,一般来说,同周期元素从左到右第一电离能逐渐增大,但N元素原子2p轨道上电子达到半充满,故其第一电离能要大于O的第一电离能,因此这四种元素的第一电离能由大到小的顺序为F(氟)>N>O>C(碳)。(2)甲、乙、丙分别为CH4、NH3、H2O,这三种分子的中心原子均采取sp3的杂化方式,它们的空间构型分别为正四面体形、三角锥形、V形,CH4分子中的键角为109°28′,而NH3分子和H2O分子上有未成键的孤电子对;孤对电子越多,排斥力越大,键角越小,所以键角顺序为H2O<NH3<CH4,故A项、B项正确,C项错误;这三种分子中,CH4为非极性分子,NH3、H2O均为极性分子,D项错误。(3)由该化合物的熔沸点可判断它为分子晶体,分子晶体中均存在范德华力,由该分子的结构可以看出其晶体中还存在极性键和配位键;CO分子和N2分子互为等电子体,故CO分子的结构与N2类似,为C≡O,因此CO分子中σ键和π键的个数比为1∶2。(4)A与F形成的化合物为HF,它的分子间存在的氢键会使HF相互结合形成(HF)n,从而使得测的相对分子质量偏高。(5)Be和Al在元素周期表中位于对角线的位置,因此它们的有些性质是相似的。
本题难度:困难
3、填空题 (13分)下表为元素周期表的一部分,请参照元素①—⑩在表中的位置,
回答下列问题:
 族 族
周期
| IA
| ?
| ?
| ?
| ?
| ?
| ?
| 0
|
1
| ①
| ⅡA
| IIIA
| IVA
| VA
| VIA
| VIIA
| ?
|
2
| ?
| ?
| ?
| ②
| ③
| ④
| ?
| ?
|
3
| ⑤
| ⑥
| ⑦
| ⑧
| ?
| ⑨
| ⑩
| ?
|
(1) ⑩的离子结构示意图为? 。
(2)④⑤⑥⑨⑩的离子半径由大到小的顺序为______________(用离子符号表示)。?
(3)④的氢化物沸点比⑨高,说明理由____________________________。
(4)上述元素构成的两个不同的10电子微粒,能反应生成两个相同的10电子微粒。写出二者反应的方程式为________?________。
(5)由④⑤两种元素组成的一种化合物加入到硫酸亚铁溶液中,立即产生红褐色沉淀,但无气体产生,该化合物的电子式?,该反应的离子方程式___?___。
参考答案:(13分)(1)?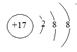 ?2分?(2)S2->Cl->Na+>Mg2+ 2分
?2分?(2)S2->Cl->Na+>Mg2+ 2分
(3)原因是液态水分子间存在氢键2分?(4)H3O++OH-=2H2O? 2分
(5)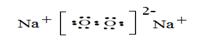 2分
2分
3Na2O2+6Fe2++6H2O=6Na++4Fe(OH)3↓+2Fe3+?3分
本题解析:略
本题难度:一般
4、填空题 工业上制取冰晶石(Na3AlF6)的化学方程式如下:
2Al(OH)3+12HF+3Na2CO3=2Na3AlF6+3CO2↑+9H2O。根据题意完成下列填空:
⑴在上述反应的反应物和生成物中,CO2的电子式?,属于弱酸的电离方程式?。若0.1mol?L-1的该弱酸溶液的pH为a,则该弱酸的电离度为?(用a表示)
⑵反应物中有两种元素在元素周期表中位置相邻,下列能判断它们的金属性或非金属性强弱的是?(选填编号)。
a.气态氢化物的稳定性? b.最高价氧化物对应水化物的酸性
c.单质与氢气反应的难易? d.单质与同浓度酸发生反应的快慢
⑶反应物中某些元素处于同一周期。它们最高价氧化物对应的水化物之间发生反应的离子方程式为?。
⑷Na2CO3俗称纯碱,属于?晶体。工业上制取纯碱的原料是?。
⑸F2能溶于NaOH溶液中生成OF2,写出该反应的化学方程式并配平
?
参考答案:(1)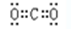 ,HF
,HF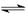 H++F-? 10a+1×100%?(2)ac
H++F-? 10a+1×100%?(2)ac
(3)Al(OH)3+OH-=AlO2-+2H2O
⑷离子? NH3、NaCl饱和溶液、CO2。
⑸2F2+2NaOH=2NaF+OF2+H2O
本题解析:(1)CO2是含有极性键的共价化合物,电子式为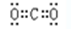 ?。HF是弱酸存在电离平衡,方程式为HF
?。HF是弱酸存在电离平衡,方程式为HF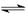 H++F-。pH=a,则氢离子浓度是10-amol/L,所以电离度
H++F-。pH=a,则氢离子浓度是10-amol/L,所以电离度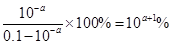
(2)两种元素分别是O和F,非金属性的比较规律:
1、由元素原子的氧化性判断:一般情况下,氧化性越强,对应非金属性越强。
2、由单质和酸或者和水的反应程度判断:反应越剧烈,非金属性越强。
3、由对应氢化物的稳定性判断:氢化物越稳定,非金属性越强。
4、由和氢气化合的难易程度判断:化合越容易,非金属性越强。
5、由最高价氧化物对应水化物的酸性来判断:酸性越强,非金属越强。(除氟元素之外)
6、由对应阴离子的还原性判断:还原性越强,对应非金属性越弱。
7、由置换反应判断:强置弱。〔若依据置换反应来说明元素的非金属性强弱,则非金属单质应做氧化剂,非金属单质做还原剂的置换反应不能作为比较非金属性强弱的依据〕
值得注意的是:氟元素没有正价态,故没有氟的含氧酸,所以最高价氧化物对应水合物的酸性最强的是高氯酸,而不是非金属性高于氯的氟元素!故规律5只适用于氟元素之外的非金属元素。
8、按元素周期律,同周期元素由左到右,随核电荷数的增加,非金属性增强;同主族元素由上到下,随核电荷数的增加,非金属性减弱。
据此可知选项ac正确,答案选ac。
(3)氢氧化铝是两性氢氧化物,能和氢氧化钠反应,方程式为Al(OH)3+OH-=AlO2-+2H2O。
(4)碳酸钠是离子化合物,形成的晶体是离子晶体,制取碳酸钠的原料是NH3、NaCl饱和溶液、CO2。
(5)根据原子守恒可知,另外的生成物是氟化钠和水,方程式为2F2+2NaOH=2NaF+OF2+H2O。
本题难度:一般
5、选择题 下列关于35 17Cl和37 17Cl的说法,错误的是
A.35 17Cl和37 17Cl中子数相差2
B.35 17Cl和37 17Cl是两种不同的核素
C.35 17Cl和37 17Cl在周期表中处于同一位置
D.35 17Cl和37 17Cl的物理性质和化学性质完全相同
参考答案:D
本题解析:略
本题难度:简单