微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 分析下列实例,根据已有的知识和经验,填写下表.
| 实例 | 影响速率的因素
夏天食物易变质
______
硫在氧气中比在空气中燃烧快
______
粉状的碳酸钙与盐酸反应比块状的碳酸钙反应快
______
氯酸钾与二氧化锰混合共热可快速产生氧气
______
工业合成氨通常要在高压下进行
______
2、实验题 (12分)控制变量法是研究化学变化量的重要思想方法。请仔细观察下表中50mL
稀盐酸和1g碳酸钙反应的实验数据:
实验
序号
| 碳酸钙
状态
| C(HCl)/ mol·l-1
| 溶液温度/℃
| 碳酸钙消失
时间/s
| 反应前
| 反应后
| 1
| 块状
| 0.5
| 20
| 39
| 400
| 2
| 粉末
| 0.5
| 20
| 40
| 60
| 3
| 块状
| 0.6
| 20
| 41
| 280
| 4
| 粉末
| 0.8
| 20
| 40
| 30
| 5
| 块状
| 1.0
| 20
| 40
| 120
| 6
| 块状
| 1.0
| 30
| 50
| 40
|
(1)该反应属于?反应(填“吸热”或“放热”)。
(2)实验5、6表明??对反应速率的影响。
(3)从本实验数据中分析,影响化学反应速率的因素还有?,能表明这
一规律的实验序号是?。
3、选择题 下列关于化学反应速率的说法中正确的是( )
A.根据化学反应速率的大小可以知道化学反应进行的快慢
B.化学反应速率为0.8mol?L-1?s-1,是指1s时,物质的量浓度为0.8mol?L-1
C.对任何化学反应来说,反应速率越大化学现象越明显
D.化学反应速率是指一定时间内,任何一种反应物浓度的减少或任何一种生成物浓度的增加
4、实验题 (12分)为探究铜与稀硝酸反应的产物及影响反应速率的主要因素,进行如下实验。
实验一 探究铜和稀硝酸反应的产物。
实验装置如图,气密性已检查。

已知:FeSO4+NO=[Fe(NO)]SO4,该反应较缓慢,待生成一定量[Fe(NO)]2+时突显明显棕色。
(1)实验开始时先将Y形试管向盛有碳酸钙的支管倾斜,缓慢滴入稀硝酸,该实验操作的目的是 。
(2)铜片和稀硝酸反应的化学方程式为 。
(3)本实验A生成的气体中,若有NO2,B的实验现象为 ;若只有NO生成,B的实验现象是 。
实验二 探究铜和稀硝酸反应速率先慢后快的原因
经过实验一,测得硝酸的浓度<6 mol?L-1,只有NO生成。当铜片与5 mol?L-1硝酸反应时,开始时反应非常缓慢,一段时间后反应速率明显加快。为探究此反应的反应速率先慢后快的原因,进行如下探究:
探究一:研究反应过程的温度变化对反应速率的影响,实验所得曲线和现象记录如下图表。
时间/min
| 现象
| 0~15
| 铜表面出现气泡,但速度很慢
| 25
| 溶液有很浅的蓝色,气泡生成速度加快
| 30
| 气泡生成速度较快,均匀冒出
| 45
| 洗气瓶中可见少量淡棕色的物质
| 50
| 溶液中蓝色明显变深,洗气瓶中突显明显棕色
|
(4)获得图2数据所需的测量仪器有________________________________。
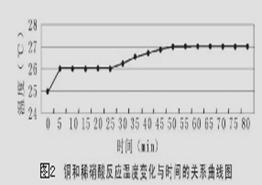
(5)从上述图表分析可得到的结论是 。
序号
| 温度
| 铜片/g
| 硝酸/mL
| 硝酸铜/g
| 1
| 25℃
| ①
| ②
| ③
| 2
| 25℃
| 5
| 20
| 0.5
| 3
| 25℃
| 5
| 20
| 1.0
|
探究二:研究化学反应产物对反应速率的影响
设计了如下实验,利用上图装置测定溶液突显明显棕色的时间。
(6)请将上表中将实验1的实验条件填写完整① ② ③
(7)通过实验发现实验1、2、3的反应速率并无明显变化,为达到实验目的还需要继续进行的实验是 。
5、填空题 金属镁及其化合物不仅在国防上有重要应用,在化学研究中也有广泛应用。
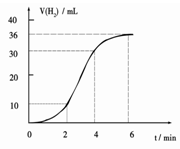
(1)某同学研究反应速率时用如下方法:取一段镁条,用砂纸擦去表面的氧化膜,使足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图所示。镁与盐酸反应的离子方程式为?;在前4min内,镁条与盐酸的反应速率逐渐加快,在4 min之后,反应速率逐渐减慢,请简述其原因:_____________。
(2)向少量的Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,固体完全溶解,写出NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式?。
(3)Mg Al可形成原电池:
编号
| 电极材料
| 电解质溶液
| 电子流动方向
| 1
| Mg Al
| 稀盐酸
| Mg流向Al
| 2
| Mg Al
| NaOH溶液
| ?
|
?
根据上表中的实验现象完成下列问题:
①实验1中Mg为?极;
②实验2中电子流动方向 ?,Al为?极,为什么? 。?
|