影响速率的因素
夏天食物易变质
______
硫在氧气中比在空气中燃烧快
______
粉状的碳酸钙与盐酸反应比块状的碳酸钙反应快
______
氯酸钾与二氧化锰混合共热可快速产生氧气
______
工业合成氨通常要在高压下进行
______
参考答案:无论反应是放热反应还是吸热反应,只要升高温度,化学反应速率一定加快,夏天温度较高,加快了化学反应速率,所以夏天食物易变质;
增大反应物的浓度,能加快反应速率,氧气的浓度大于空气中氧气的浓度,所以硫在氧气中燃烧比在空气中燃烧快;
增大反应物的接触面积,能加快反应速率,粉末状的碳酸钙比块状的碳酸钙与盐酸的接触面积大,所以反应速率快;
二氧化锰在氯化钾的分解反应中作催化剂,催化剂能降低反应需要的活化能,所以能加快反应速率;
增大压强,气体的浓度增大,反应速率加快,所以合成氨需要在高压下进行;
故答案为:温度;浓度;接触面积大小;催化剂;压强.
本题解析:
本题难度:一般
2、实验题 (12分)控制变量法是研究化学变化量的重要思想方法。请仔细观察下表中50mL
稀盐酸和1g碳酸钙反应的实验数据:
实验
序号
| 碳酸钙
状态
| C(HCl)/ mol·l-1
| 溶液温度/℃
| 碳酸钙消失
时间/s
| 反应前
| 反应后
| 1
| 块状
| 0.5
| 20
| 39
| 400
| 2
| 粉末
| 0.5
| 20
| 40
| 60
| 3
| 块状
| 0.6
| 20
| 41
| 280
| 4
| 粉末
| 0.8
| 20
| 40
| 30
| 5
| 块状
| 1.0
| 20
| 40
| 120
| 6
| 块状
| 1.0
| 30
| 50
| 40
|
(1)该反应属于?反应(填“吸热”或“放热”)。
(2)实验5、6表明??对反应速率的影响。
(3)从本实验数据中分析,影响化学反应速率的因素还有?,能表明这
一规律的实验序号是?。
参考答案:(1)?放热?(2)?温度?(3)?反应物接触面积? ①②
本题解析:(1)反应后溶液的无毒升高,说明反应是放热反应。
(2)实验5、6不同的是温度,因此探究的是温度对反应速率的影响。
(3)根据反应中的变量可知,不同的还有反应物的接触面积,因此影响化学反应速率的因素还有反应物接触面积,对应的实验是1、2。
本题难度:一般
3、选择题 下列关于化学反应速率的说法中正确的是( )
A.根据化学反应速率的大小可以知道化学反应进行的快慢
B.化学反应速率为0.8mol?L-1?s-1,是指1s时,物质的量浓度为0.8mol?L-1
C.对任何化学反应来说,反应速率越大化学现象越明显
D.化学反应速率是指一定时间内,任何一种反应物浓度的减少或任何一种生成物浓度的增加
参考答案:A.反应速率的大小衡量反应的快慢,则根据化学反应速率的大小可以知道化学反应进行的快慢,故A正确;
B.反应速率为平均速率,不是指1s时,应为1s内浓度变化量,故B错误;
C.反应速率与反应现象无关,反应速率快的可能现象不明显,如盐酸与NaOH反应,故C错误;
D.不能利用纯固体、纯液体表示反应速率,利用反应体系中浓度变化的反应物或生成物表示反应速率,故D错误;
故选:A.
本题解析:
本题难度:简单
4、实验题 (12分)为探究铜与稀硝酸反应的产物及影响反应速率的主要因素,进行如下实验。
实验一 探究铜和稀硝酸反应的产物。
实验装置如图,气密性已检查。

已知:FeSO4+NO=[Fe(NO)]SO4,该反应较缓慢,待生成一定量[Fe(NO)]2+时突显明显棕色。
(1)实验开始时先将Y形试管向盛有碳酸钙的支管倾斜,缓慢滴入稀硝酸,该实验操作的目的是 。
(2)铜片和稀硝酸反应的化学方程式为 。
(3)本实验A生成的气体中,若有NO2,B的实验现象为 ;若只有NO生成,B的实验现象是 。
实验二 探究铜和稀硝酸反应速率先慢后快的原因
经过实验一,测得硝酸的浓度<6 mol?L-1,只有NO生成。当铜片与5 mol?L-1硝酸反应时,开始时反应非常缓慢,一段时间后反应速率明显加快。为探究此反应的反应速率先慢后快的原因,进行如下探究:
探究一:研究反应过程的温度变化对反应速率的影响,实验所得曲线和现象记录如下图表。
时间/min
| 现象
| 0~15
| 铜表面出现气泡,但速度很慢
| 25
| 溶液有很浅的蓝色,气泡生成速度加快
| 30
| 气泡生成速度较快,均匀冒出
| 45
| 洗气瓶中可见少量淡棕色的物质
| 50
| 溶液中蓝色明显变深,洗气瓶中突显明显棕色
|
(4)获得图2数据所需的测量仪器有________________________________。
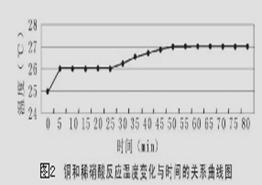
(5)从上述图表分析可得到的结论是 。
序号
| 温度
| 铜片/g
| 硝酸/mL
| 硝酸铜/g
| 1
| 25℃
| ①
| ②
| ③
| 2
| 25℃
| 5
| 20
| 0.5
| 3
| 25℃
| 5
| 20
| 1.0
|
探究二:研究化学反应产物对反应速率的影响
设计了如下实验,利用上图装置测定溶液突显明显棕色的时间。
(6)请将上表中将实验1的实验条件填写完整① ② ③
(7)通过实验发现实验1、2、3的反应速率并无明显变化,为达到实验目的还需要继续进行的实验是 。
参考答案:(1)利用生成的CO2将整个装置内的空气赶尽,避免NO和O2反应生成NO2对气体产物的观察产生干扰 (2分) (2)3Cu +8HNO3(稀)=3Cu (NO3)2+2NO↑+4H2O (2分)
(3)B瓶溶液变为棕黄色;B瓶溶液出现棕色 (各1分,共2分)
(4)温度计和秒表(或使用pH传感器) (2分)
(5)反应溶液温度升高不是使反应速率加快的主要因素(2分)
(6)5;20;0 (1分) (7)研究NO对反应速率的影响 (2分)
本题解析:(1)由于装置中含有空气,能氧化生成的NO,所以实验开始时先将Y形试管向盛有碳酸钙的支管倾斜,缓慢滴入稀硝酸,二者反应生成CO2,利用生成的CO2将整个装置内的空气赶尽,避免NO和O2反应生成NO2对气体产物的观察产生干扰。
(2)铜片和稀硝酸反应的化学方程式为3Cu +8HNO3(稀)=3Cu (NO3)2+2NO↑+4H2O。
(3)本实验A生成的气体中,若有NO2,NO2溶于水生成硝酸,硝酸具有强氧化性,能氧化亚铁离子为铁离子,所以B的实验现象为B瓶溶液变为棕黄色;若只有NO生成,由于FeSO4+NO=[Fe(NO)]SO4,则B的实验现象是B瓶溶液出现棕色。
(4)根据图像可知需要测量温度和时间,因此需要的仪器是温度计和秒表。
(5)根据图像可知温度升高后反应速率增加的程度不是很大,这说明反应溶液温度升高不是使反应速率加快的主要因素。
(6)要研究化学反应产物对反应速率的影响,则反应物铜片和硝酸应该是相铜的,即①中铜片质量为5g;②中硝酸的浓度是体积20ml;根据2、3可知1中硝酸铜为0。
(7)由于生成物不止一种,所以为达到实验目的还需要继续进行的实验是研究NO对反应速率的影响。
考点:考查外界条件对反应速率影响的实验方案设计与研究
本题难度:困难
5、填空题 金属镁及其化合物不仅在国防上有重要应用,在化学研究中也有广泛应用。
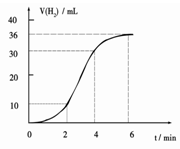
(1)某同学研究反应速率时用如下方法:取一段镁条,用砂纸擦去表面的氧化膜,使足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图所示。镁与盐酸反应的离子方程式为?;在前4min内,镁条与盐酸的反应速率逐渐加快,在4 min之后,反应速率逐渐减慢,请简述其原因:_____________。
(2)向少量的Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,固体完全溶解,写出NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式?。
(3)Mg Al可形成原电池:
编号
| 电极材料
| 电解质溶液
| 电子流动方向
| 1
| Mg Al
| 稀盐酸
| Mg流向Al
| 2
| Mg Al
| NaOH溶液
| ?
|
?
根据上表中的实验现象完成下列问题:
①实验1中Mg为?极;
②实验2中电子流动方向 ?,Al为?极,为什么? 。?
参考答案:
(1)Mg+2H+=Mg2++H2↑(1分)
镁和盐酸反应是放热反应,随着反应体系温度升高,反应速率增大(1分);
4min后由于溶液中H+浓度降低,所以导致反应速率减小(1分)。
(2)Mg(OH)2(s)+2NH4+= Mg2++2NH3·H2O(2分)
(3) ① 负极(1分)②Al流向Mg(1分),负(1分),Al能和NaOH溶液反应而Mg不能,故Al作负极,Mg作正极。(2分)
本题解析:(1)盐酸是强电解质,应写成离子的形式:Mg+2H+=Mg2++H2↑(1分)
镁和盐酸反应是放热反应,随着反应的不断进行,放出的热量使得反应体系温度升高,导致反应速率增大;但是随着时间的推移,4min后由于溶液中H+浓度降低,尽管热量还在放出,但是此时温度对化学反应速率的影响程度已远小于浓度的变化对化学反应速率的影响,所以导致反应速率减小(1分)。
(2)Mg(OH)2(s)+2NH4+= Mg2++2NH3·H2O(2分)
(3)该题中一定要注意反应条件的转变:在酸性条件下镁比铝的金属性强,但是在碱性条件下,铝显得比镁要活泼。
本题难度:一般
|