微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列热化学方程式错误的是(注:△H的绝对值均正确)
[? ]
A.C2H5OH(l)+3O2(g)= 2CO2(g) +3H2O(g);△H= +1367.0 kJ/mol(燃烧热)
B.NaOH (a q) + HCl (aq) = NaCl(aq) +H2O (l); △H= -57.3kJ/mol(中和热)
C.S(s) + O2(g) = SO2(g);△H= -269.8kJ/mol(反应热)
D.2NO2=O2+2NO;△H=+116.2kJ/mol(反应热)
参考答案:AD
本题解析:
本题难度:简单
2、选择题 下列说法不正确的是?(?)
①用润湿的pH试纸测定溶液的pH时,一定会产生误差
②明矾、胆矾、冰醋酸、硫酸钡、硫酸钠均为电解质
③某温度下测得纯水的c(H+)=2×10-7mol/L,则其中的c(OH-)=5×10-5mol/L
④所有的燃烧反应都为放热反应
A.仅有①④
B.仅有②③
C.仅有①③
D.全不正确
参考答案:C
本题解析:略
本题难度:一般
3、选择题 水的电离过程为H2O  ?OH-+H+?,在25℃、35℃时其离子积分别为K(25℃)=1×10-14 、K(35℃)=2.1×10-14 。则下列叙述中正确的是(?)
?OH-+H+?,在25℃、35℃时其离子积分别为K(25℃)=1×10-14 、K(35℃)=2.1×10-14 。则下列叙述中正确的是(?)
A.在35℃,纯水中C(H+)>C(OH-)
B.水的电离度α(25℃)>α(35℃)
C.25℃时,向纯水中加入盐酸或氢氧化钠都能使水的电离平衡逆向移动,水的离子积减小
D.某温度下纯水中C(H+) 为2×10-7 mol/L,则此时的C(OH-) 也为2×10-7 mol/L
参考答案:D
本题解析:温度升高水的离子积变大,电离度也变大,因为电离吸热。纯水中C(H+)=C(OH-) ,AB错误。25℃时,向纯水中加入盐酸或氢氧化钠都能使水的电离平衡逆向移动,但是温度不变水的离子积不变。C错误。某温度下纯水中C(H+)= C(OH-) =2×10-7 mol/L,D正确。
本题难度:简单
4、填空题 (12分)①制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。
②用NaOH测定滤液的浓度:准确称量1.000gNaOH固体质量,配制成250mL溶液,准确量取25.00mL溶液装在碱式滴定管,滴加2滴酚酞作指示剂。把滤液装在酸式滴定管中,调节液面排除气泡后,滤液的凹液面刚好在“0”刻度,滴定NaOH溶液,达到终点记录读数。实验重复3次。记录见下表。
滴定次数
| NaOH溶液体积/mL
| 滴定消耗滤液体积/mL
|
1
| 25.00
| 20.02
|
2
| 25.00
| 17.10
|
3
| 25.00
| 19.98
|
请回答下列问题:
(1)TiCl4水解生成TiO2·xH2O的化学方程式为_______________________________。
(2) 配制成250mL溶液使用的量具是?,指示剂还可用____________;
(3) 滴定终点的现象是_______________________。
(4) 滤液中溶质的物质的量浓度为_____________。
(5) 若在滴定终点读取滴定管刻度时,俯视标准液液面,使对测定结果________。 (填“偏高”、“偏低”或“无影响”)
参考答案:(12分)(1)TiCl4+(x+2)H2O ? TiO2·xH2O↓+4HCl(2分)
? TiO2·xH2O↓+4HCl(2分)
(2) 250mL容量瓶(1分,必须答250mL,若无则无分)?甲基橙(1分)
(3)浅红色溶液变为无色,30秒内不褪色 (2分,两要点各1分)
(4)0.1250 mol?L-1 (4分,若不是4位有效数字无分)(5)偏高(2分)
本题解析:(1)TiCl4+(x+2)H2O ? TiO2·xH2O↓+4HCl
? TiO2·xH2O↓+4HCl
滴定终点的现象要半分钟不褪色,俯视标准液液面,水加少了,结果偏高。
本题难度:简单
5、填空题 (18分)
(1)、配制FeSO4溶液时,常加入少量铁粉,目的是___________________________________;常加入少量H2SO4,目的是__________________________________________________。
(2)、泡沫灭火剂包括Al2(SO4)3溶液(约1 mol·L-1)、NaHCO3溶液(约1 mol·L-1)及起泡剂。使用时发生的化学反应的离子方程式是_____________________________。
(3)、已知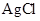 为难溶于水和酸的白色固体,
为难溶于水和酸的白色固体,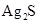 为难溶于水和酸是黑色固体。
为难溶于水和酸是黑色固体。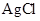 和?
和?
水的悬浊液中加入足量的 溶液并振荡,结果白色固体完全转化为黑色固体。?
溶液并振荡,结果白色固体完全转化为黑色固体。?
①、写出白色固体转化黑色固体的化学方程式:?;
②、白色固体转化成黑色固体的原因是:?。
(4)、已知下列物质在20℃下的Ksp如下,试回答下列问题:
化学式
| ①? AgCl
| ②? AgBr
| ③? Ag2S
| ④? Ag2CrO4
|
Ksp
| 2.0×10-10
| 5.4×10-13
| 2.0×10-48
| 2.0×10-12
|
①20℃时,上述四种银盐饱和溶液中,Ag+物质的量浓度由大到小的顺序是(填序号)
_____________________________。
②向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,=_______________ 。
参考答案:(1)防止Fe2+被氧化 (2分) ,防止Fe2+水解。(2分);
(2)Al3++ 3HCO3-?=Al(OH)3 ↓+ 3CO2↑? (3分)?(3) ①2AgCl+Na2S==Ag2S+2NaCl(3分);
②因为Ag2S的溶解度比AgCl的溶解度小,沉淀溶解平衡向离子浓度减小的方向移动。(2分)
(4)?①、④ >①>②>③?(3分);?②、2.7×10-3 (3分)
本题解析:(1)亚铁离子易被氧化生成铁离子,加入铁粉可以防止Fe2+被氧化;硫酸亚铁水解酸性,例如硫酸可以防止Fe2+水解。
(2)铝离子水解显酸性,碳酸氢钠水解显碱性,二者相互促进,生成氢氧化铝和CO2,方程式为Al3++ 3HCO3-?=Al(OH)3 ↓+ 3CO2↑。
(3)因为Ag2S的溶解度比AgCl的溶解度小,沉淀溶解平衡向离子浓度减小的方向移动。所以氯化银能转化为硫化银,方程式为2AgCl+Na2S==Ag2S+2NaCl。
(4)①根据四种物质的溶度积常数以及化学式可知,四种溶液中银离子浓度分别是1.4×10-5mol/L、7.3×10-7mol/L、1.6×10-16mol/L、1.6×10-4mol/L,所以溶液中银离子浓度大小顺序为④ >①>②>③。
②根据题意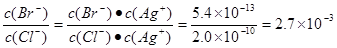
本题难度:一般