|
高考化学知识点总结《盐类水解的原理》高频试题巩固(2017年最新版)(十)
2017-07-18 02:45:10
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下a mol·L-1 CH3COOH稀溶液和bmol·L-1KOH稀溶液等体积混合,下列判断一定错误的是( )
A.若c(OH-)>c(H+),则a=b
B.若c(K+)>c(CH3COO-),则a>b
C.若c(OH-)=c(H+),则a>b
D.若c(K+)<c(CH3COO-),则a<b
|
参考答案:D
本题解析:若a=b,则溶质为醋酸钾,c(K+)>c(CH3COO-),c(OH-)>c(H+);
若a>b,则溶质为醋酸和醋酸钾,溶液可能呈酸性,c(OH-)<c(H+),c(K+)<c(CH3COO-);也可能呈中性,c(OH-)=c(H+),c(K+)=c(CH3COO-);也可能呈碱性,c(OH-)>c(H+),c(K+)>c(CH3COO-);
若a<b,则溶质为醋酸钾和氢氧化钾,溶质呈碱性,c(OH-)>c(H+),c(K+)>c(CH3COO-)。
考点:酸碱中和
点评:分类讨论思想的应用。
本题难度:困难
2、填空题 (14分)常温下,将0.01mol NH4Cl和0.002mol NaOH溶于水配成1L混合溶液,
(1)该溶液中存在的电离平衡是______________________________________和________________________________,水解反应为_________________________。(用方程式表示)
(2)溶液中c( Na+ )= 、c( Cl—)=
(3)c ( NH4+) 0.01mol/L(填 > 、 < 或=)
(4)写出溶液中电荷守恒的等式______________________________________ 。
参考答案:(1)NH3·H2O  NH4++OH-; H2O NH4++OH-; H2O  H++OH-;NH4++H2O H++OH-;NH4++H2O  NH3·H2O+H+;(2)0.002mol·L-1;0.01 mol·L-1 (3) < NH3·H2O+H+;(2)0.002mol·L-1;0.01 mol·L-1 (3) <

本题解析:略
本题难度:一般
3、填空题 某二元酸(化学式用H2B表示)在水中的电离方程式是H2B=H++HB-;HB-
参考答案:
本题解析:
本题难度:困难
4、填空题 (14分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
实验
编号
| HA物质的量浓度(mol·L-1)
| NaOH物质的量浓度(mol·L-1)
| 混合溶液的pH
| 甲
| 0.2
| 0.2
| pH=a
| 乙
| c
| 0.2
| pH=7
| 丙
| 0.2
| 0.1
| pH>7
| 丁
| 0.1
| 0.1
| pH=9
|
(1)不考虑其它组的实验结果,单从甲组情况分析,用a来说明HA是强酸还是弱酸,若a 7,则HA是强酸;若a 7,则HA是弱酸(填<、>、=)。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2 (选填“是”或“否”)。混合液中离子浓度c(A-)与 c(Na+)的大小关系是 。
(3)丙组实验结果分析,HA是 酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是 。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)= mol·L-1。
参考答案:(1)a=7;a>7 (2)否;c(A-)=c(Na+) (3)弱 c(Na+)>c(A-)>c(OH-)>c(H+) (4)10-5
本题解析:(1)如果HA是强酸,则等体积、等物质的量浓度的HA与NaOH混合,溶液呈中性,如果HA是弱酸,则等体积、等物质的量浓度的HA与NaOH混合,溶液呈酸性。
(2)如果HA为弱酸,与等浓度,等体积的NaOH溶液反应后,溶液呈中性,则需要酸过量,所以c大于0.2,根据电荷守恒:c(H+)+ c(Na+)= c(OH-)+ c(A-),若c(H+)= c(OH-)则c(Na+)= c(A-)。
(3)根据丙可知,酸过量,反应后的溶液呈碱性,说明酸是弱酸。根据电荷守恒:c(H+)+ c(Na+)= c(OH-)+ c(A-),c(H+)< c(OH-),溶质电离出来的离子大于水电离出来的离子,所以溶液中离子浓度大小关系为c(Na+)>c(A-)>c(OH-)>c(H+)。
(4)酸和碱等体积等浓度混合,则恰好完全反应,溶液显碱性,说明生成了强碱弱酸盐。溶液中的H+都是由水电离出来的,所以水电离出来的c(H+)= c(OH-)=10-5mol/L。
考点:盐类水解
点评:本题属于盐类水解的综合性习题,是高考中的热点习题。计算水电离出来的离子,要考虑溶液中的H+或OH-是由谁电离出来的,再根据Kw去求。
本题难度:困难
5、选择题 在一定条件下发生下列反应,其中属于盐类水解反应的是
[? ]
A.NH4++2H2O NH3·H2O+H3O+ NH3·H2O+H3O+
B.HCO3-+ H2O H3O+ + CO32- H3O+ + CO32-
C.HS-+H+=== H2S
D.Cl2+H2O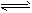 H++Cl-+HClO H++Cl-+HClO
参考答案:A
本题解析:
本题难度:简单
|