微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
I.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤;并在常温常压下结晶,制得粗硫酸镁(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子)。
II.提纯粗硫酸镁:将粗硫酸镁在酸性条件下溶解,加入适量的0.1 mol·L-H2O2溶液,再调节溶液pH至7~8,并分离提纯。
III.制取氢氧化镁:向步骤II所得溶液中加入过量氨水。
已知:金属离子氢氧化物沉淀所需pH
| Fe3+
| Al3+
| Fe2+
| Mg2+
|
开始沉淀时
| 1.5
| 3.3
| 6.5
| 9.4
|
沉淀完全时
| 3.7
| 5.2
| 9.7
| 12.4
|
请回答下列问题:
(1)步骤II中,可用于调节溶液pH至7~8的最佳试剂是 (填字母序号)。
A. MgO B. Na2CO3 C. 蒸馏水
(2)Fe2+与H2O2溶液反应的离子方程式为 。
(3)工业上常以Mg2+的转化率为考察指标,确定步骤III制备氢氧化镁工艺过程的适宜条件。其中,反应温度与Mg2+转化率的关系如右图所示。
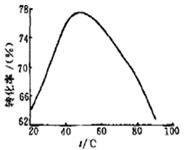
①步骤III中制备氢氧化镁反应的离子方程式为 。
②根据图中所示50 ℃前温度与Mg2+转化率之间 的关系,可判断此反应是
(填“吸热”或“放热”)反应。
③图中,温度升高至50 ℃以上Mg2+转化率下降的可能原因是 。
④ Ksp表示沉淀溶解平衡的平衡常数。已知:
Mg(OH)2(s)  Mg2+ (aq)+ 2OH- (aq) Ksp = c(Mg2+)·c2(OH-) = 5.6×10-12
Mg2+ (aq)+ 2OH- (aq) Ksp = c(Mg2+)·c2(OH-) = 5.6×10-12
Ca(OH)2(s)  Ca2+ (aq) + 2OH- (aq) Ksp = c(Ca2+)·c2(OH-) = 4.7×10-6
Ca2+ (aq) + 2OH- (aq) Ksp = c(Ca2+)·c2(OH-) = 4.7×10-6
若用石灰乳替代氨水, (填“能”或“不能”)制得氢氧化镁,理由是 。
参考答案:(14分)(1)A (2分)
(2)2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O (2分)
(3)① Mg2+ + 2NH3·H2O = Mg(OH)2↓ + 2NH4+ (2分)
② 吸热 (2分)
③ 温度过高时,氨水受热分解,浓度降低,Mg2+转化率下降 (2分)
④ 能, Mg(OH)2的溶解度小于Ca(OH)2,可发生沉淀的转化 (各2分)
本题解析:(1)步骤II中,可用于调节溶液pH至7~8的目的是和酸反应提高溶液pH,使Fe3+、Al3+等杂质离子沉淀分离除去,
A、加入氧化镁和酸反应能提高溶液PH,生成镁离子,不加入杂质离子,可选;
B、加入碳酸钠能调节溶液PH但假如了钠离子,引入杂质,故不选;
C、蒸馏水对提高溶液pH不好,故不选;
故答案为:A;
(2)Fe2+与H2O2溶液反应亚铁离子被过氧化氢氧化为三价铁离子便于完全沉淀,过氧化氢被还原为水,反应的离子方程式为:2Fe2++H2O2+2H+
本题难度:困难
2、选择题 自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析正确的是?
[? ]
A.CuS的溶解度大于PbS的溶解度
B.原生铜的硫化物具有还原性,而铜蓝没有还原性
C.CuSO4与ZnS反应的离子方程式是Cu2+ + S2-=CuS↓
D.整个过程涉及的反应类型有氧化还原反应和复分解反应
参考答案:D
本题解析:
本题难度:一般
3、填空题 工业上制备BaCl2的工艺流程图如下
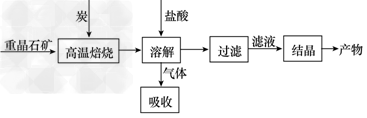
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s)+4C(s) 4CO(g)+BaS(s) ΔH1=571.2?kJ/mol ①
4CO(g)+BaS(s) ΔH1=571.2?kJ/mol ①
BaSO4(s)+2C(s) 2CO2(g)+BaS(s) ΔH2=226.2?kJ/mol ②
2CO2(g)+BaS(s) ΔH2=226.2?kJ/mol ②
(1)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为__________________________________________。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, =________。
=________。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)反应C(s)+CO2(g) 2C O(g)的ΔH3=____kJ/mol。
2C O(g)的ΔH3=____kJ/mol。
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是__________________________________________________。
参考答案:(1)S2-+H2O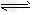 HS-+OH-、HS-+H2O
HS-+OH-、HS-+H2O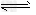 H2S+OH-
H2S+OH-
(2)2.7×10-3
(3)172.5
(4)使BaSO4得到充分还原(或提高BaS的产量);①②为吸热反应,炭和氧气反应放热可维持反应所需高温
本题解析:
本题难度:一般
4、简答题 难溶化合物的饱和溶液存在溶解平衡,例如:AgCl(s)

Ag++Cl-,Ag2CrO4(s)?

2Ag++CrO42-.在一定温度下,已知:Ksp(AgCl)=c(Ag+)?c(Cl-)=1.8×10-10,Ksp(Ag2CrO4)=[c(Ag+)]2?c(+CrO42-)=1.9×10-12,现用0.01mol?L-1?AgNO3溶液滴定0.01mol?L-1?KCl和0.001mol?L-1?K2CrO4混合溶液,通过计算回答:
(1)Cl-、CrO42-谁先沉淀?
(2)当刚出现Ag2CrO4沉淀时,溶液中Cl-的物质的量浓度是多少?(设混合溶液在反应中体积不变)
参考答案:(1)AgCl饱和所需Ag+浓度c(Ag+)=KSP(AgCl)C(Cl-)=1.8×10-100.01mol/L=1.8×10-8 mol/L,
Ag2CrO4饱和所需Ag+浓度c(Ag+)=
本题解析:
本题难度:一般
5、选择题 下列物质与水作用形成的溶液能与NH4CI反应生成 NH3的是
A.二氧化氮
B.钠
C.硫酸镁
D.二氧化硅
参考答案:B
本题解析:NH4++H2O NH3●H2O+H+,只要能使平衡往正方向进行,而且在一定条件下温度升高或者氨水的浓度足够大就可能生成NH3,A项:产生NO气体,错误; B项:钠消耗了H+而且该反应放热可以产生氨气,正确;C项:不能产生氨气,错误;D项:二氧化硅可以与氢氟酸反应,跟其他酸很难反应,所以也没有氨气产生,错误。
NH3●H2O+H+,只要能使平衡往正方向进行,而且在一定条件下温度升高或者氨水的浓度足够大就可能生成NH3,A项:产生NO气体,错误; B项:钠消耗了H+而且该反应放热可以产生氨气,正确;C项:不能产生氨气,错误;D项:二氧化硅可以与氢氟酸反应,跟其他酸很难反应,所以也没有氨气产生,错误。
考点定位:本题考查了铵离子水解平衡。
本题难度:一般