微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 制备锌印刷电路板是用稀硝酸腐蚀锌板,产生的废液称“烂板液”。“烂板液”中含硝酸锌外,还含有自来水带入的Cl—和Fe3+。在实验室里,用“烂板液”制取ZnSO4·7H2O的过程如下:
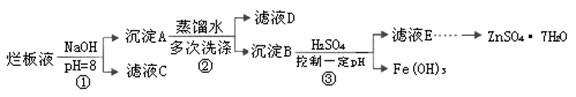
(1)若稀硝酸腐蚀锌板时还原产物为N2O,氧化剂与还原剂的物质的量之比是 。
(2)若步骤①的pH>12,则Zn(OH)2溶解生成四羟基合锌酸钠。写出Zn(OH)2被溶解的离子方程式 。
(3)滤液D中除了含有OH—离子外,还含有的阴离子有 (填离子符号)。
(4)若滤液E的pH=4,c(Zn2+)=2mol·L-1,c(Fe3+)=2.6×l0-9mol·L-1,能求得的溶度积是 (填选项)。
A.Ksp[Zn(OH)2] B.Ksp[Zn(OH)2]和Ksp[Fe(OH)3] C.Ksp[Fe(OH)3]
(5)步骤③要控制pH在一定范围。实验室用pH试纸测定溶液pH的方法是: 。
(6)已知:①Fe(OH)3(s) Fe3+(aq)+3OH-(aq) ; ΔH=" a" kJ?mol-1
Fe3+(aq)+3OH-(aq) ; ΔH=" a" kJ?mol-1
②H2O(l)  H+(aq)+OH-(aq) ;ΔH=" b" kJ?mol-1
H+(aq)+OH-(aq) ;ΔH=" b" kJ?mol-1
请写出Fe3+发生水解反应的热化学方程式: 。
若①的溶度积常数为KSP,②的离子积常数为KW,Fe3+发生水解反应的平衡常数:
K= 。(用含KSP、KW的代数式表示)
2、计算题 硫酸银的溶解度较小,25℃时,每100g水仅溶解0.836g。
(1)25℃时,在烧杯中放入6.24g硫酸银固体,加200g水,经充分溶解后,所得饱和溶液的体积为
200mL。计算溶液中Ag+的物质的量浓度。
(2)若在上述烧杯中加入50 mL 0.0268 mol/L BaCl2溶液,充分搅拌,溶液中Ag+的物质的量浓度是多少?
(3)在(1)题烧杯中需加入多少升0.0268mol/L BaCl2溶液,才能使原溶液中Ag+浓度降低至0.0200mol/L?
3、填空题 已知:
①25℃时弱电解质的电离平衡常数:Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Ksp(CaF2)=1.5×10-10。
②25℃时,2.0×10-3mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
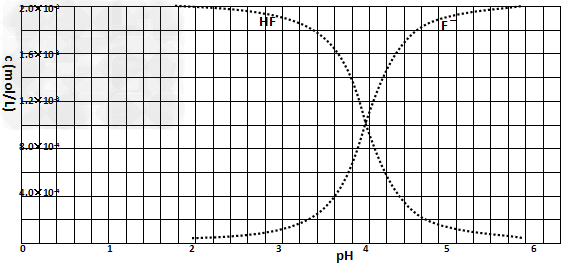
请根据信息回答下列问题:
(1)25℃时,将20mL?0.10?mol/L?CH3COOH溶液和20mL?0.10?mol/LHSCN溶液分别与20mL?0.10?mol/LNaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如下图:
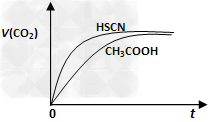
反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是______________,反应结束后所得两溶液中,c(CH3COO-)_______c(SCN-) (填“>”、“<”或“=”)。
(2)25℃时,HF电离平衡常数的表达式Ka=_______, 25℃时,HF电离平衡常数Ka______。
(3)25℃时,将4.0×10-3?mol/LHF溶液与4.0×10-4?mol/L?CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生_____________?。
4、选择题 氯化银在水中存在溶解平衡:AgCl?Ag++Cl-.在相同温度下,将足量氯化银分别放入相同体积的下列溶液中,Ag+的浓度最小的是( )
A.0.1mol/L?HCl
B.蒸馏水
C.0.1mol/LAlCl3
D.0.1mol/LMgCl2
5、选择题 下表中的实验操作能达到实验目的或能得出相应结论的是
选项
| 实验操作
| 实验目的或结论
|
A
| 向盛有1mL 0.01mol·L-1AgNO3溶液的试管中滴加5滴0.01mol·L-1NaCl溶液,有白色沉淀生成,再向其中滴加 0.01mol·L-1NaI溶液,产生黄色沉淀。
| 常温下,
Ksp(AgCl)>Ksp(AgI)
|
B
| 取少量 KClO3晶体溶于适量的蒸馏水,再加入硝酸酸化的AgNO3溶液。
| 检验KClO3中的氯元素
|
C
| 向某溶液中滴加Ba(NO3)2溶液产生白色沉淀,再加稀盐酸沉淀消失。
| 说明原溶液中一定含有CO32-或 SO32-
|
D
| 将混有Ca(OH)2杂质的Mg(OH)2样品,放入水中搅拌成浆状后,加入足量饱和氯化镁溶液充分搅拌、过滤,沉淀用蒸馏水洗涤。
| 除去Mg(OH)2样品中的Ca(OH)2
|
?