微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列物质的水溶液,由于水解而呈酸性的是? (? )
A.NaHSO4
B.NaHCO3
C.HCl
D.NH4Cl
参考答案:D
本题解析:NaHSO4、HCl、NH4Cl三者呈酸性,而前者是电离造成的;NaHCO3水解呈碱性。
本题难度:简单
2、选择题 常温下,已知0.1 mol·L-1 HA(一元酸)溶液中c(H+):c(OH-)=1010,0.5 mol·L-1 B(OH)2(二元碱)溶液中pH=14。将浓度均为0.1 mol·L-1的两种溶液等体积混合后,混合溶液中下列离子浓度的大小关系正确的是 (? )
A.c(H+)<c(OH-)<c(A-)<c(B2+)
B.c(OH-)<c(H+)<c(B2+)<c(A-)

C.c(H+)+2c(B2+)=c(OH-)+c(A-)
D.2c(A-)=c(B2+)>c(H+)=c(OH-)
参考答案:C
本题解析::常温下c(H+)·c(OH-)=10-14,故0.1 mol·L-1HA溶液中c(H+)为10-2 mol·L-1,HA为弱酸。0.5 mol·L-1,B(OH)2溶液中c(OH-)=1 mol·L-1,B(OH)2为强碱。等浓度的两溶液等体积混合后,B(OH)2恰好反应一半,得到B(OH)2和BA的混合溶液,显碱性,离子浓度顺序为c(OH-)>c(B2+)>c(A-)>c (H+),A、B、D均错。C项应用了电荷守恒,正确。
本题难度:简单
3、选择题 0.1mol/L的K2S溶液中,有关粒子的浓度大小关系正确的是(? )
A.c(K+)+c(H+)=c(S2—)+c(HS—)+c(OH—)
B.c(K+)+ c(S2—) = 0.3mol/L
C.c(K+)=c(S2—)+c(HS—)+c(H2S)
D.c(OH-)=c(H+)+c(HS—)+2c(H2S)
参考答案:D
本题解析:A不正确,不符合电荷守恒,应该是c(K+)+c(H+)=2c(S2—)+c(HS—)+c(OH—);B和C都不正确,不符合物料守恒,分别应该是c(K+)+ c(S2—)+c(HS—)+c(H2S) = 0.3mol/L、c(K+)=2c(S2—)+2c(HS—)+2c(H2S);D正确,符合质子守恒,答案选D。
点评:判断溶液中离子浓度关系的关键是掌握几个守恒关系式,即电荷守恒、物料守恒和质子守恒。
本题难度:一般
4、选择题 已知KHSO3溶液呈弱酸性。在0.1mol·L-1KHSO3溶液中,下列关系正确的是
A.c(K+)+ c(H+) =c(HSO3-)+ c(OH-)+ c(SO32-)
B.c(HSO3-) + c(SO32-) = 0.1mol·L-1
C.c(SO32-) < c(H2SO3)
D.c(K+) = c(H2SO3) + c(HSO3-) + c(SO32-)
参考答案:D
本题解析:在0.1mol·L-1KHSO3溶液中:A项根据电荷守恒:c(K+)+ c(H+)=c(HSO3-)+c(OH-)+2c(SO32-),故原等式不成立;B项根据S元素守恒:c(HSO3-)+ c(H2SO3) + c(SO32-) = 0.1mol·L-1,故原等式不成立;C项中因HSO3-显酸性,说明电离大于水解,故c(SO32-)>c(H2SO3),原关系错误;D项根据物料守恒:c(K+) = c(H2SO3) + c(HSO3-) + c(SO32-),正确。3溶液中离子浓度的关系的正确性判断。
本题难度:一般
5、选择题 10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
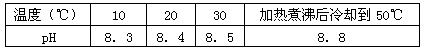
(1)甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为________________。
(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度_________(填“大于”或“小于”)NaHCO3。
(3)丙同学认为甲、乙的判断都不充分。丙认为:只要在加热煮沸后的溶液中加入足量的试剂X,若产生沉淀,则_________(填“甲”或“乙”)判断正确。试剂X是_________(填序号)。
?A.Ba(OH)2溶液 B.BaC12溶液 C.NaOH溶液 D.澄清的石灰水
将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则_____________ (填“甲”或“乙”)判断正确。
参考答案:(1)HCO3-+H2O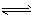 H2CO3+OH-
H2CO3+OH-
(2)大于
(3)乙;B?;甲
本题解析:
本题难度:一般