微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。下列说法正确的是(双选)? ( )。
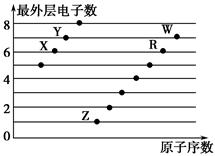
A.X和R在同一周期
B.原子半径:W>R>X
C.气态氢化物的稳定性:Y>X
D.X、Z形成的化合物中可能含有共价键
参考答案:CD
本题解析:由于均为短周期元素,故X、Y在第二周期,Z、R、W在第三周期,X、R位于第ⅥA族,Y、W位于第ⅦA族,原子半径R>W,故A、B错误;X、Z形成的化合物为Na2O和Na2O2,Na2O2中既含有离子键也含有共价键。
本题难度:一般
2、填空题 (11分)几种短周期元素的原子半径及主要化合价见下表:

分析上表的有关数据,并结合已学过知识,请用化学用语到答下列问题。
(1)写出D元素在周期表中的位置___________________。
(2)含20克F的最高价氧化物的水化物的稀溶液与足量B的氢化物的稀溶液反应放出热量a kJ,请写出该反应的热化学反应方程式____________________________。
(3)用电子式表示F2C2的形成过程______________________________。
(4)BA2能与盐酸反应得到黄绿色气体,试写出化学反应方程式:__________________,
B、C、F的最高价氧化物对应的水化物形成溶液,浓度均为0.1mol/L时,pH由大到小的顺序为___________________。
(5)lmol F2A2与水反应生成的溶液与lL 0.5mol/LEB3溶液反应的离子方程式为
______________________________。
参考答案:(1)第三周期ⅣA族(1分)
(2) HCl(aq)? +? NaOH(aq) =H2O(l)? +? NaCl(aq);△H=-2akJ/mol(2分)
(3)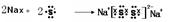 (2分)
(2分)
(4)8HC1 + 2C1O2===5C12↑ + 4H2O(2分),? NaOH>HClO4>H2SO4(2分)
(5)Al3++4OH- = [Al(OH)4]-(写为A1O2-也可) (2分)
本题解析:本题考查元素推断及元素周期表和周期律的有关知识。由表中数据结合元素周期表。可以确定A、B、C、D、E、F分别为O、Cl、S、Si、Al、Na。(1)Si处于元素周期表中第三周期ⅣA族;(2)20克NaOH和HCl反应放出热量a kJ,则1molNaOH和HCl反应放出热量就是2a kJ,则反应的热化学反应方程式为HCl(aq) +NaOH(aq)=H2O(l)+NaCl(aq);△H=-2akJ/mol。(3)Na2S2可以类比于Na2O2,再写Na2S2形成过程可表示为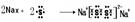 。(4)ClO2与盐酸反应得到黄绿色气体——Cl2,根据电子得失守恒可写出反应的方程式为8HC1+2C1O2=5C12↑+4H2O。HClO4、H2SO4、NaOH中前两者为强酸,后者是强碱,pH分别为1、0.7、11,pH由大到小的顺序为NaOH>HClO4>H2SO4。(5)lmolNa2O2与水反应可生成2molNaOH,lL 0.5mol/L AlCl3中AlCl3的物质的量为0.5mol,2molNaOH恰好能将Al3+转化为A1O2-,故反应的离子方程式为Al3++4OH- = A1O2-+2H2O。
。(4)ClO2与盐酸反应得到黄绿色气体——Cl2,根据电子得失守恒可写出反应的方程式为8HC1+2C1O2=5C12↑+4H2O。HClO4、H2SO4、NaOH中前两者为强酸,后者是强碱,pH分别为1、0.7、11,pH由大到小的顺序为NaOH>HClO4>H2SO4。(5)lmolNa2O2与水反应可生成2molNaOH,lL 0.5mol/L AlCl3中AlCl3的物质的量为0.5mol,2molNaOH恰好能将Al3+转化为A1O2-,故反应的离子方程式为Al3++4OH- = A1O2-+2H2O。
本题难度:一般
3、填空题 W、X、Y和Z是周期表中前20号元素,已知:
①W的阳离子和Y的阴离子具有相同的核外电子排布,且能形成组成为WY的化合物;
②Y和Z属同族元素,它们能形成两种常见化合物;
③X和Z属同一周期元素,它们能形成两种气态化合物;
④W和X能形成组成为WX2的化合物;
⑤X和Y不在同一周期,它们能形成组成为XY2的化合物。
请回答:
(1)W元素是____________;Z元素是____________。
(2)化合物WY和WX2的化学式分别是____________和____________。
(3)Y和Z形成的两种常见化合物的分子式是____________和____________。
(4)写出X和Z形成的一种气态化合物跟WZ反应的化学方程式:____________。
参考答案:(1)钙?氧
(2)CaS? CaC2
(3)SO2? SO3
(4)CO2+CaO====CaCO3
本题解析:因W、X、Y、Z都是前20号元素,根据②可知Y和Z分别为硫和氧;根据①知W为钙,根据③知X为碳,从而可得出。
本题难度:简单
4、选择题 短周期元素甲、乙、丙、丁、戊五种元素在元素周期表中的位置如下图所示,其中戊是同周期中原子半径最小的元素。下列有关判断正确的是( )
A.最外层电子数:甲>乙>丙>丁>戊
B.简单离子的离子半径:戊>丁>丙
C.含有丁元素的酸有多种
D.乙的氢化物多种多样,丙、丁、戊的氢化物各有一种
参考答案:C
本题解析:戊是同周期中原子半径最小的元素,则戊是Cl,所以丁是S,丙是N,乙是C,甲是B。同周期自左向右最外层电子数逐渐最多,A不正确。核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,因此B中应该是丁>戊>丙,B不正确。C正确,例如硫酸、亚硫酸、氢硫酸等。N的氢化物不止一种,例如氨气、N2H4等,D不正确,答案选C。
本题难度:简单
5、选择题 某元素的原子序数为7,对它的认识有错误的是
A.它处于元素周期表中第二周期VA族
B.它的最高正价为+5,负价为-3
C.它的最高价氧化物对应水化物是一种强酸
D.它的非金属性比磷弱比氧强
参考答案:D
本题解析:
答案:D
A.正确,两个电子层,最外层5个电子,它处于元素周期表中第二周期VA族;
B.正确,最外层5个电子,它的最高正价为+5,负价为-3
C.正确,它的最高价氧化物对应水化物是一种强酸:HNO3;
D.不正确,它的非金属性比磷强比氧弱:非金属性O>N>P
本题难度:一般