微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一密闭容器中加入A、B、C三种气体,保持一定温度,在t1~t4时刻测得各物质的浓度如下表。据此判断下列结论正确的是
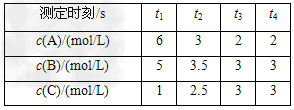
[? ]
A.在t3时刻反应已经停止
B.A的转化率比B的转化率低
C.在容器中发生的反应为:2A+B 2C
2C
D.在t2~t3内A的平均反应速率为:[1/(t3-t2)]?mol/(L·s)
参考答案:D
本题解析:
本题难度:一般
2、填空题 化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:
TaS2(s)+2I2(g) TaI4(g)+S2(g) (Ⅰ)
TaI4(g)+S2(g) (Ⅰ)
某温度反应(Ⅰ)的K=4,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为? ?。
(2)如下图所示,反应(Ⅰ)在石英真空管中进行,先在温度高(T2)的一端放入未提纯的TaS2粉末和少量I2(g),加热一段时间后,在另一端温度低(T1)的一端得到了纯净的TaS2晶体,则该正反应的△H?0(填“>”或“<”),上述反应体系中循环使用的物质是?。
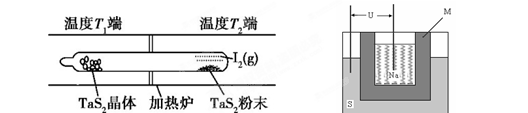
(3)上图为钠硫高能电池的结构示意图。该电池的工作温度为320℃左右,电池反应为2Na + xS=Na2Sx,正极的电极反应式为____________________________。M(由Na2O和Al2O3制得)的两个作用是________________________________________________和隔离钠与硫。
(4)写出Na2S溶液水解的离子方程式_______________________________________,Na2S溶液中c(H+)+ c(Na+)=________________。
参考答案:(1)80%(2分)(2)>(1分); I2(2分)(3)xS+2e-=Sx2-(2分);离子导电(2分)
(4)S2-+H2O HS-+OH-、HS-+H2O
HS-+OH-、HS-+H2O H2S+OH-(2分,只写第一步也可得分)
H2S+OH-(2分,只写第一步也可得分)
c(HS-)+2c(S2-)+c(OH-) (2分)
本题解析:(1)? TaS2(s)+2I2(g) TaI4(g)+S2(g)
TaI4(g)+S2(g)
起始量(mol)? 1? 0? 0
转化量(mol)? 2x? x? x
平衡量(mol)? 1-2x? x? x
由于反应前后体积不变,因此可以用物质的量代替物质的量浓度表示其平衡常数,即
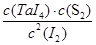 =4=
=4=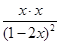
解得x=0.4
所以I2(g)的平衡转化率为 ×100%=80%
×100%=80%
(2)加热一段时间后,在另一端温度低(T1)的一端得到了纯净的TaS2晶体,这说明低温有利于TaS2晶体的生成,因此逆反应是放热反应,则正方应是吸热反应,即△H>0;先在温度高(T2)的一端放入未提纯的TaS2粉末和少量I2(g),而最后又产生单质碘,因此单质碘是可以循环的物质。
(3)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。根据方程式2Na + xS=Na2Sx可知,钠是还原剂,做负极,S单质是氧化剂,在正极得到电子,因此正极反应式为xS+2e-=Sx2-。在熔融状态下,Na2O和Al2O3能电离出阴阳离子而使电解质导电,因此另外一种作用是离子导电。
(4)硫化钠是强碱弱酸盐,S2-水解溶液显碱性,因此Na2S溶液水解的离子方程式为S2-+H2O HS-+OH-、HS-+H2O
HS-+OH-、HS-+H2O H2S+OH-;根据电荷守恒可知Na2S溶液中c(H+)+ c(Na+)=c(HS-)+2c(S2-)+c(OH-)。
H2S+OH-;根据电荷守恒可知Na2S溶液中c(H+)+ c(Na+)=c(HS-)+2c(S2-)+c(OH-)。
本题难度:一般
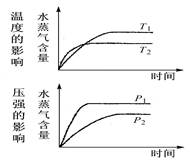
3、选择题 一定条件下,水蒸气含量随反应时间的变化趋势符合下图的是(? )
A.CO2(g)+2NH3( g) CO(NH2)2(s)+H2O(g); △H<0
CO(NH2)2(s)+H2O(g); △H<0
B.CO2(g)+ H2(g)  CO(g)+H2O(g); △H>0
CO(g)+H2O(g); △H>0
C.CH3CH2OH CH2=CH2(g)+ H2O(g); △H>0
CH2=CH2(g)+ H2O(g); △H>0
D.2C6H5CH2CH3(g)+O2(g) 2C6H-5CH=CH2(g)+2H2O(g); △H<0
2C6H-5CH=CH2(g)+2H2O(g); △H<0
参考答案:A
本题解析:根据题给图像知,温度为T2时反应先达到平衡,温度越高,反应速率越快,到达平衡的时间就越短,T2>T1,温度为T2时,反应达平衡时水蒸气的含量降低,则升高温度,平衡向逆反应方向移动,逆反应为吸热反应,正反应为放热反应,△H<0;压强为P1时反应先达到平衡,压强越大,反应速率越快,到达平衡的时间就越短,P1>P2,压强为P1时,反应达平衡时水蒸气的含量升高,则增大压强,平衡向正反应方向移动,则正反应为气体物质系数减小的反应。分析题给选项,选A。
本题难度:简单
4、填空题 (9分)现有可逆反应A(g)+B(g)?3C(g),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系:

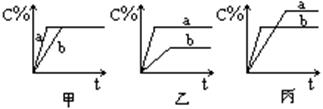
(1)若甲图中两条曲线分别表示有催化剂和无催化剂时的情况,则___曲线是表示有催化剂时的情况。
(2)若乙图中的a曲线表示200℃和b曲线表示100℃时的情况,则此可逆反应的正反应是_____热反应。
(3)若丙图中两条曲线分别表示不同压强下的情况,则____曲线是表示压强较大的情况。
参考答案:(1)a?(2)吸?(3)b
本题解析:(1)中考查催化剂对反应速率及转化率的影响,催化剂一般是加快化学反应速率,缩短到达平衡所用的时间,不能提高反应物的转化率,故选a。(2)中考查温度对反应热效应的影响,根据“先拐先平”的原则,a曲线先达到平衡,说明a曲线情况是温度高;再根据温度升高,平衡向着体系温度降低的方向移动,即该可逆反应的正反应是吸热反应。(3)中考查压强对反应速率及转化率的影响,压强增大,反应速率加快,反应首先达到平衡,即b曲线先达到平衡;再根据压强增大,C%反而降低,说明正反应是气体体积增大的反应,跟题意相一致,故选b。
本题难度:一般
5、填空题 在一定条件下,逆反应A2(g)+B2(g)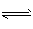 2C(g) ,达到了化学平衡状态,经测得平衡时c(A2)=0.5 mol·L-1, c( B2) =0.1 mol·L-1,c(C)=1.6mol·L-1,若A2、B2、C的 起始浓度分别以amol·L-1,b mol·L-1,c mol·L-1表示, 请填写下列空白。
2C(g) ,达到了化学平衡状态,经测得平衡时c(A2)=0.5 mol·L-1, c( B2) =0.1 mol·L-1,c(C)=1.6mol·L-1,若A2、B2、C的 起始浓度分别以amol·L-1,b mol·L-1,c mol·L-1表示, 请填写下列空白。
(1)a、b应满足的关系是____。
(2)a的取值范围是____。
参考答案:(l)a =b+0.4
(2)0.4≤a≤1.3
本题解析:
本题难度:一般