微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 在一定体积的密闭容器中,进行如下反应:A(g)? B(g)+C(g),其化学平衡常数K和温度t的关系如下表所示:

? toC
| 700
| 800
| 830
| 1000
| 1200
|
K
| 0.6
| 0.9
| 1.0
| 1.7
| 2.6
|
?
回答下列问题:
(1)该反应化学平衡常数的表达式:K=?。
(2)在下图中用实线画出该反应的能量变化曲线,同时在此基础上用虚线画出加入催化剂后的能量变化曲线。

(3)一定温度和体积下,下列说法中能说明该反应达平衡状态的是?。
①容器内压强不变
②混合气体中c(C)不变
③混合气体的密度不变
④v(A)=v(B)
⑤化学平衡常数K不变
⑥混合气体平均式量不变
(4)反应时间(t)与容器内气体A的浓度数据见下表
时间t/min
| 0
| 1
| 2
| 4
| 8
| 16
| 20
|
C(A)/(mol·L-1)
| 10.4
| 8.6
| 7.5
| 6.6
| 5.9
| 5.5
| 5.5
|
?
回答下列问题:
①2~4min内,B的平均速率为?。
②反应达平衡时,A的转化率为?。
③欲提高A韵平衡转化率,可以采取的措施有?。
参考答案:
(1)c(B)·c(C)/c(A)(2分)
(2) 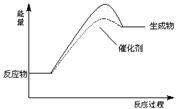 ?(3分)
?(3分)
(3)①②⑥(3分)
(4)①0.45 mol/(L·min)(2分) ② 47.1%(2分) ③升高温度或减小B、C的浓度(2分)
本题解析:(2)使用催化剂活化能降低,但起始能量不变;(3)变量不变达平衡,①容器内压强是变量,其不变 表示反应平衡,正确; ②体系中每一种成分的量均是变量,c(C)不变表示反应平衡,正确;
③混合气体的质量不变,体积固定,故混合气体的密度是恒量,错误;④反应速率应是正逆反应速率相等,v(A)=v(B)只是表示单方向,错误;⑤温度一定,化学平衡常数K不变 ,错误; ⑥混合气体平均式量与气体的物质的量成反比,是变量,正确。(4)根据公式直接计算①0.45 mol/(L·min) ② 47.1%,若欲提高A韵平衡转化率,可使可以采取的措施有升高温度或减小B、C的浓度或减小压强。
本题难度:一般
2、选择题 右图表示可逆反应mA(g) + nB(g)  ?pC(g)在不同温度(T)、压强(P)下,生成物C的物质的量分数x(C)的变化情况。下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是?
?pC(g)在不同温度(T)、压强(P)下,生成物C的物质的量分数x(C)的变化情况。下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是?

A.吸热反应,m+n<p?
B.吸热反应,m+n>p
C.放热反应,m+n<p?
D.放热反应,m+n>p
参考答案:D
本题解析:分析图(1),P1比P2先达平衡,说明P1>P2,压强增大,生成物C的物质的量分数增大,说明正反应是气体体积缩小的反应;再分析图(2),T2比T1先达平衡,说明T2> T1,温度降低,生成物C的物质的量分数增大,说明正反应是放热反应。
本题难度:简单
3、选择题 在密闭容器中进行A(g)+4B(g) 2C(g)+3D(g)的反应,其中A、B、C、D的起始浓度分别为0.1 mol·L-1、0.4 mol·L-1、0.2 mol·L-1、0.3 mol·L-1,当反应达到平衡时,各物质的物质的量浓度不可能是(?)
2C(g)+3D(g)的反应,其中A、B、C、D的起始浓度分别为0.1 mol·L-1、0.4 mol·L-1、0.2 mol·L-1、0.3 mol·L-1,当反应达到平衡时,各物质的物质的量浓度不可能是(?)
A.c(A)="0.15" mol·L-1? B.c(B)="0.8" mol·L-1
C.c(C)="0.3" mol·L-1? D.c(D)="0.5" mol·L-1
参考答案:B
本题解析:可逆反应不可能进行完全。
本题难度:简单
4、填空题 (13分)(1)对于下列反应:2SO2 + O2?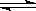 ?2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。
?2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。
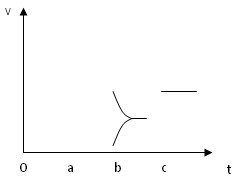
(2)下图表示在密闭容器中反应:2SO2+O2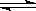 2SO3?△H<0?达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况。
2SO3?△H<0?达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况。

①a b过程中改变的条件可能是?;
②b c过程中改变的条件可能是?;
③若加入催化剂,请将反应速度变化情况画在c~d处。
(3)请用化学平衡移动知识解释久置的氯水(尤其是长期放置在见光环境),最后浅黄绿色消失,溶液变成稀盐酸:?
参考答案:(1)2mol/(L·min); 1mol/(L·min);(各两分,其中数值错没分,没单位扣一分)
(2)升温;减小SO3浓度;(各一分)
 (图1分)
(图1分)
(3)在氯水中存在平衡:Cl2+H2O 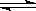 ?HCl + HClO ,HClO见光易分解为HCl和O2,使得平衡体系中HClO浓度减小,平衡向正反应方向移动,Cl2浓度减小.HCl浓度增大,最后浅绿色消失,溶液变成稀盐酸.(3分)
?HCl + HClO ,HClO见光易分解为HCl和O2,使得平衡体系中HClO浓度减小,平衡向正反应方向移动,Cl2浓度减小.HCl浓度增大,最后浅绿色消失,溶液变成稀盐酸.(3分)
本题解析:(1)υ(SO2)=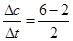 =2mol/(L·min),υ(SO2)=
=2mol/(L·min),υ(SO2)= ×υ(SO2)=1mol/(L·min)
×υ(SO2)=1mol/(L·min)
(2)①a b过程中正逆反应速率均增大,且平衡逆向移动,应该是升温
②b c过程中逆反应速率瞬间减小,平衡正向移动,应该是减小了产物浓度
③若加入催化剂,正逆反应速率同倍数增大
(3)见答案
本题难度:一般
5、填空题 (15分)铁及其化合物与生产、生活关系密切。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
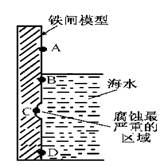
①该电化腐蚀称为?。
②图中A、B、C、D四个区域,生成铁锈最多的是?(填字母)。
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:
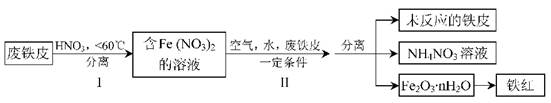
①步骤I若温度过高,将导致硝酸分解。硝酸分解的化学方程式为?。
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为?。
③上述生产流程中,能体现“绿色化学”思想的是?(任写一项)。
(3)已知t℃时,反应FeO(s)+CO(g) Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。
①t℃时,反应达到平衡时n(CO):n(CO2)=?。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)转化率为50%,则x=?。
参考答案:
⑴①吸氧腐蚀?②B
⑵①4HNO3 4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O
②4Fe+10HNO3=4 Fe(NO3)2+NH4NO3+3H2O
③氮氧化物排放少(或其他合理答案)
⑶①4:1?②0.05
本题解析:⑴①钢铁在海水(中性环境)中发生的应该是吸氧腐蚀。
②在B点的海水中氧气浓度最大,发生的吸氧腐蚀最快,生成的铁锈最多。
⑵①硝酸受热分解产生NO2、O2、H2O,通过氧化还原反应的化合价升降法将其配平。
②通过示意图分析,确定HNO3与Fe该反应的生成物除了Fe(NO3)2还有NH4NO3,先根据得失电子守恒有4Fe+10HNO3--4 Fe(NO3)2+ NH4NO3,再根据原子守恒得4Fe+10HNO3=4 Fe(NO3)2+ NH4NO3+3H2O。
③该生产流程中生成了NH4NO3,没有产生NO、NO2等有毒气体,减少了氮氧化物的排放量,符号“绿色化学”思想。
⑶①据题意有K=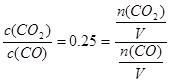 ,则n(CO):n(CO2)=4:1。
,则n(CO):n(CO2)=4:1。
②据题意有n(CO):n(CO2)=(x-0.01):0.01=4:1,解得x=0.05 mol。
本题难度:一般