| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《化学平衡状态的判断》考点预测(2017年强化版)(四)
 则“人工固氮”新方 法的热化学方程式可表示为:  参考答案:A 本题解析:若加入少量醋酸钠固体,则CH3COOH 本题难度:一般 5、填空题 (15分)随着氮氧化物污染的日趋严重,国家将于“十二五”期间加大对氮氧化物排放的控制力度。目前,消除氮氧化物污染有多种方法。
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是?。 ③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H?0(填“>”、“ =”或“<”)。 (2)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知: ①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)?△H=-574 kJ·mol-1 ②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)?△H=-1160 kJ·mol-1 ③H2O(g)=H2O(l)?△H=-44.0 kJ·mol-1 写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式?。 (3)以NO2、O2、熔融NaNO3组成的燃料电池装置如图所示,在使用过程中石墨I电极反应生成一种氧化物Y,有关电极反应可表示为?。 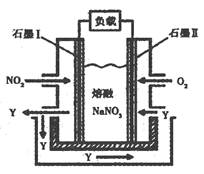 参考答案:(1)①0.56?②减小CO2的浓度(合理答案均可)?③< 本题解析:(1)①根据表中数据可知,反应进行到20min是气体物质的浓度不再发生变化,所以平衡常数= 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学试题《有机化学反应类型.. | |