微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 已知5种短周期元素的原子序数大小顺序是C>A>B>D>E;A、C同周期,B、C同主族;A与B形成的离子化合物A2B中,离子的电子数相同,其电子总数为30;D和E可形成4原子10电子分子,请回答:
(1)写出元素名称:A______?B______?C______?D______?E______
(2)A、B、C三种离子半径由小到大的顺序是(写离子符号)______.
(3)C离子的结构示意图是______.
参考答案:5种短周期元素的原子序数大小顺序是C>A>B>D>E;A与B形成的离子化合物A2B中,离子的电子数相同,其电子总数为30,则离子的核外电子数为10,故A为钠元素,B为氧元素;B、C同主族,则C为硫元素,A、C同周期,符合;D和E可形成4原子10电子分子,D的原子序数小于8,则D为氮元素,E为氢元素.
综上所述,A为钠元素,B为氧元素,C为硫元素,D为氮元素,E为氢元素.
(1)由上述分析可知,A为钠元素,B为氧元素,C为硫元素,D为氮元素,E为氢元素,故答案为:钠;氧;硫;氮;氢;
(2)A为钠元素,B为氧元素,C为硫元素,三者的简单离子分别为Na+、O2-、S2-,Na+、O2-电子层排布相同,核电荷数越大离子半径越小,所以Na+<O2-,O2-、S2-最外层电子数相同,电子层越多离子半径越大,所以O2-<S2-,所以离子半径Na+<O2-<S2-,故答案为:Na+<O2-<S2-;
(3)C为硫元素,C离子为S2-,核外有18个电子,有3个电子层,最外层电子数为8,结构示意图是
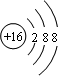
,故答案为:

.
本题解析:
本题难度:一般
2、填空题 有A、B、C、D、E五种微粒(原子或离子),已知:
A原子核外M电子层上有2个电子;
B原子得到2个电子后,其电子层结构与Ne相同;
C离子带有一个单位的正电荷,核电荷数为11;
D离子核外有18个电子,质子数比电子数少一个;
E微粒不带电,其质量数为1.
试回答下列问题:
(1)依次写出A、B、C、D、E各微粒的符号
A______、B______、C______、D______、E______;
(2)C、D所属元素组成的化合物是______化合物(填共价或离子),用电子式表示其形成过程______.
参考答案:A原子核外M电子层上有2个电子,则处于ⅡA,A为Mg原子;B原子得到2个电子后,其电子层结构与Ne相同,B的质子数为10-2=8,B为氧原子;C离子带有一个单位的正电荷,核电荷数为11,则C离子为Na+;D离子核外有18个电子,质子数比电子数少一个,质子数为18-1=17,D离子为Cl-;E微粒不带电,其质量数为1,不含中子,则E为H原子,
(1)由上述分析可知,A为Mg、B为O、C为Na+、D为Cl-、E为H原子,故答案为:Mg;O;Na+;Cl-;H;
(2)C、D所属元素组成的化合物是NaCl,属于离子化合物,用电子式表示其形成过程: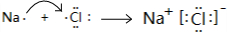 ,
,
故答案为:离子;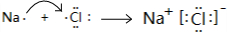 .
.
本题解析:
本题难度:一般
3、简答题 有A、B、C、D、E五种元素,其中A、B、C属于同一周期,且原子序数B>C,A原子最外层p能级的电子数等于次外层的电子总数,B元素可分别与A、C、D、E生成常见的RB2型化合物,并知在DB2和EB2中,D与B的质量比为7:8,E与B的质量比为1:1.根据以上条件,回答下列问题:
(1)推断五种元素分别是(用元素名称回答):D______,E______.
(2)指出C元素在元素周期表中的位置______.E元素的最高价氧化物的分子构型为______.
(3)沸点DB2______EB2(填“>”、“<”或“=”等于),理由______
(4)写出与EB3分子互为等电子体并含A、B、C任意两种元素的微粒______(填1种)
(5)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,下列是一些键的键能:SiCl4(g)+2H2(g)?高温?Si(s)+4HCl(g)?通过计算该反应是______热(填“吸”或
“放”)______kJ/mol
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C
键能/kJ?mol-1
460
360
436
431
176
347
参考答案:p能级电子数不超过6,A原子最外层p能级的电子数等于次外层的电子数总数,则A的核外电子排布为1s22s22p2,应为C元素,B元素可分别与A、C、D、E生成常见的RB2型化合物,A为C元素,故CB2中B元素的化合价为-2价,且A、B、C属于同一周期,则B为O元素,C为N元素,可形成NO2化合物,在DB2和EB2中,D与B的质量比为7:8,则有M(D):M(O)=7:4,M(D)=7×164=28,D应为Si元素;E与B的质量比为1:1,则M(E)=2M(O)=2×16=32,所以E为S元素,
(1)由上述分析可知,D为Si元素,E为S元素,故答案为:硅;硫;
(2)C是N元素,在元素周期表中处于第二周期第ⅤA族,E元素的最高价氧化物为SO3,S原子价层电子对为3+6-2×32=3,没有孤对电子,故为平面三角形,
故答案为:第二周期第ⅤA族;平面三角形;
(3)SiO2是原子晶体,SO2是分子晶体,故沸点SiO2>SO2,故答案为:>;SiO2是原子晶体,SO2是分子晶体,沸点SiO2>SO2.
(4)与SO3分子互为等电子体并含C、O、N任意两种元素的微粒为NO3-等,故答案为:NO3-;
(5)晶体硅是正四面体的立体网状结构,每个Si原子成4个Si-Si键,每个Si-Si键为1个Si原子提供12,故1mol晶体硅中Si-Si键为1mol×4×12=2mol,反应SiCl4(g)+2H2(g)=Si(s)+4HCl(g)的反应热△H=4×360kJ/mol+2×436kJ/mol-2×176kJ/mol-4×431kJ/mol=236kJ/mol,故为吸热反应,
故答案为:吸;236.
本题解析:
本题难度:一般
4、简答题 A、B、C、D为原子序数小于18的四种元素:
①A的原子的电子层数等于最外层电子数;
②A与B处于同一周期,B与D可形成离子化合物D2B,该化合物的水溶液显碱性;
③C的离子核内质子数与核外电子数之和为18;
④A、C、D三种元素的离子具有相同的电子层排布.
推断A~D各为何种元素,并填空:
(1)A______;B______;C______;D______.
(2)四种元素离子半径的大小顺序为______.
(3)用离子方程式表示D2B水溶液呈碱性的原因______.
参考答案:A、B、C、D均为短周期元素.由①可知A的族序数等于周期数,可能为H、Be、Al.由②可知;短周期可形成D2B离子化合物有Li2O、Na2O、Na2S,它们的水溶液为碱性.由③可知若C为阴离子Cn-,则设核电荷数c,有2c+n=18(n取偶数),n=2时,c=8,为O,O2-离子在熔融的金属氧化物中存在.n=4时,c=7为N,无N4+离子,舍去,n不可能大于5.若C为阳离子Cn+,由2c-n=18(n取偶数),n=2时,c=10,为Ne,舍去;n=4时,c=11为Na,无Na4+,舍去;n=6时,c=12,为Mg,无Mg6+舍去,故C为O元素,由④知A、C、D必为相邻周期元素.所以C为O,则A为Al,D为Na.
(1)所以A、B、C、D分别是Al、S、O、Na,故答案为:Al;S;O;Na;
(2)根据元素周期律,电子层结构越大,离子半径越大,相同电子层结构的离子,离子半径随着核电荷数的增大而减小,故答案为:r(S2-)>r(O2-)>r(Na+)>r(Al3+);
(3)Na2S是强碱弱酸盐,若酸根离子水解而使溶液呈碱性,故答案为:S2-+H2O水解
本题解析:
本题难度:一般
5、简答题 甲、乙、丙、丁为前三周期元素形成的微粒,它们的电子总数相等.已知甲、乙、丙为双原子分子或负二价双原子阴离子,丁为原子.
(1)丙与钙离子组成的离子化合物跟水反应产生一种可燃性气体,反应的化学方程式是______
(2)乙在高温时是一种还原剂,请用化学方程式表示它在工业上的一种重要用途:______
(3)在一定条件下,甲与O2反应的化学方程式是______
(4)丁的元素符号是______,它的原子结构示意图为______
(5)丁的氧化物的晶体结构与______的晶体结构相似.
参考答案:甲、乙、丙、丁为前三周期元素形成的微粒,它们的电子总数相等,丙与钙离子组成的离子化合物跟水反应产生一种可燃性气体,所以丙为C22-,微粒为14电子微粒,甲、乙为双原子分子或负二价双原子阴离子,则可能为CO、
N2,丁为原子,应为Si,
(1)碳化钙与水反应生成氢氧化钙和乙炔,乙炔为可燃性气体,该反应为CaC2+2H2O═C2H2↑+Ca(OH)2,
故答案为:CaC2+2H2O═C2H2↑+Ca(OH)2;
(2)乙在高温时是一种还原剂,乙为CO,常用来冶炼金属,如CO+CuO?△?.?CO2↑+Cu,
故答案为:CO+CuO?△?.?CO2↑+Cu;
(3)甲为氮气,在高温或放电条件下与氧气反应生成NO,该反应为N2+O2??高温或放电?.?2NO,
故答案为:N2+O2??高温或放电?.?2NO;
(4)丁为Si,质子数为14,原子结构示意图为
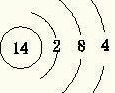
,故答案为:Si;

;
(5)Si的晶体为原子晶体,与金刚石的晶体类型相同,故答案为:金刚石.
本题解析:
本题难度:一般
|