微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 原子的核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数为
2n2-1。下列有关X的说法中不正确的是
[? ]
A.X能形成化学式为X(OH)3的碱
B.X可能形成化学式为KXO3的含氧酸钾盐
C.X原子的最外层电子数和核电荷数肯定为奇数
D.X能与某些金属元素形成化合物
参考答案:A
本题解析:
本题难度:一般
2、选择题 有A,B两种原子,A原子的M层比B原子的M层少3个电子,B原子的L层电子数恰为A原子L层电子数的2倍,A和B分别是
[? ]
A.硅原子和钠原子
B.硼原子和氢原子
C.氮原子和碳原子
D.碳原子和铝原子
参考答案:D
本题解析:
本题难度:简单
3、选择题 有短周期元素A、B、C,其中A和B同周期,B和C同主族,且最外层电子数之和为17,核电荷数之和为
31,则A、B、C是
[? ]
A. C、N、Si
B. N、P、O
C. N、O、S
D. C、Si、S
参考答案:C
本题解析:
本题难度:简单
4、选择题 科学家现已发现116号元素(用R表示),并成功制造出
R子,下列叙述正确的是( )
①最外层电子有6个;
②原子核外有六个电子层;
③R是金属元素;
④R是非金属元素;
⑤其最高价氧化物的水化物是强酸;
⑥其最高价氧化物分子式为RO3;
⑦R元素的相对原子质量为293;
⑧不能形成稳定的气态氢化物.
A.②③⑥⑧
B.①④⑤⑦
C.①③⑥⑧
D.①④⑤⑦⑧
参考答案:第七周期稀有气体的原子序数应为118,故116号元素处于第七周期ⅥA族,
①该元素处于ⅥA族,主族元素最外层电子数=主族族序数=6,故正确;
②该元素处于第七周期,故原子核外电子层数=周期数=7,故错误;
③同主族自上而下金属性增强,该元素金属性比Po强,应为金属元素,故正确;
④同主族自上而下金属性增强,该元素金属性比Po强,应为金属元素,故错误;
⑤该元素为金属元素,其最高价氧化物对应水化物不可能为强酸,故错误;
⑥最高正化合价为+6,故其最高价氧化物分子式为RO3,故正确;
⑦293为该核素116293R的质量数,不是R元素的相对原子质量,故错误;
⑧属于金属元素,不能形成稳定的气态氢化物,故正确,
故选C.
本题解析:
本题难度:简单
5、简答题 现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍.X原子的M能层上有4个未成对电子.请回答下列问题:
(1)写出C、D、E三种原子第一电离能由大到小的顺序为______.
(2)A原子与B、C、D原子形成最简单化合物的稳定性由强到弱的顺序为______,根据价层电子对互斥理论预测BA2D的分子构型为______.
(3)某蓝色晶体,其结构特点是X2+、X3+离子分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个BC-.与A同族且相差两个周期的元素R的离子位于立方体的恰当位置上.根据其结构特点可知该晶体的化学式为(用最简正整数表示)______
(4)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似(如右图所示),其中3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO
晶格能/kJ?mol-1
786
715
3401
|
根据表格中的数据:判断KCl、MgO、TiN?三种离子晶体熔点从高到低的顺序是______.MgO晶体中一个Mg2+周围和它最邻近且等距离的O2-有______个.
(5)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和Cr2O3中,适合作录音带磁粉原料的是______.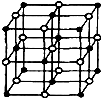
参考答案:根据B的s能级上电子总数等于p能级上电子总数的2倍,则电子排布式为:1s22s22p2,故为C,B、C、D、E、A五种非金属元素原子半径依次减小,,则为同周期,故B为N,C为O,D为F,A为H,
(1)同周期从左到右第一电离能依次增大,但是在第ⅤA族的氮原子,p轨道上半充满状态稳定,不易失去电子,故答案为:F>N>O;
(2)C、N、O原子的得电子能力O>N>C,得电子能力越强,其氢化物的稳定性越强,根据价层电子对互斥理论,NH2O的中心原子的杂化方式为sp2杂化,为平面三角形,故答案为:H2O>NH3>CH4;平面三角形;
(3)X原子的M能层上有4个未成对电子,则电子排布式为:1s22s22p63s23p63d64s2,故为Fe,BC-为CN-,与A同族且相差两个周期的元素R即为Na,根据立方体结构,每个晶胞中含有钠、铁、和氢氰根的个数为:1、2、6,分子式为:NaFe2(CN)6,故答案为:NaFe2(CN)6;?
(4)晶格能越大则晶体熔点越高,则TiN>MgO>KCl,MgO晶体类型为立方体,其中一个Mg2+周围和它最邻近且等距离的O2-有6个,故答案为:TiN>MgO>KCl;6;
(5)金属铬离子比钒离子Cr2O3含未成对电子多,则磁性大,磁记录性能越好,故答案为:Cr2O3.
本题解析:
本题难度:一般