微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 镁-H2O2酸性燃料电池采用海水作电解质,下列结论错误的是
A.电池总反应为:Mg+H2O2=Mg(OH)2
B.正极发生的电极反应为:H2O2+2H++2e-=2H2O
C.工作时,正极周围海水的pH增大
D.电池工作时,溶液中的H+ 向正极移动
参考答案:A
本题解析:A错,该电池总反应式为: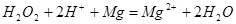 ;B正确,正极为电子流入一极,则正极发生的电极反应为:H2O2+2H++2e-=2H2O;C正确,由正极电极反应式可得工作时,正极周围海水的pH增大;D正确,在工作过程中,阳离子向正极移动;
;B正确,正极为电子流入一极,则正极发生的电极反应为:H2O2+2H++2e-=2H2O;C正确,由正极电极反应式可得工作时,正极周围海水的pH增大;D正确,在工作过程中,阳离子向正极移动;
本题难度:一般
2、选择题 下列说法不正确的是
[? ]
A.反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的△H<0
B.常温下,在0.1mol/L氨水中,加入少量NH4Cl晶体,溶液的pH减小
C.铅蓄电池在放电过程中,正、负极质量都减小
D.温度一定时,水的离子积常数Kw不随外加酸(碱)浓度的改变而改变
参考答案:C
本题解析:
本题难度:一般
3、选择题 镍氢碱性电池的总反应式是MH+NiO(OH)
NiO+M+H2O(MH表示合金M贮存氢后的简式).根据此反应式判断,下列叙述正确的是( )
A.电池放电时,电池负极周围溶液的OH-不断增大
B.电池放电时,镍元素被氧化
C.电池放电时,每转移1mol电子,负极有1mol NiO(OH)被还原
D.电池充电时,阳极反应为NiO-e-+OH-=NiO(OH)
参考答案:A.放电时电池负极反应为MH-e-+OH-=H2O+M,电池负极周围溶液的OH-不断减小,故A错误;
B.电池放电时,正极反应为:NiO(OH)+H2O+e-=OH-+Ni(OH)2,镍元素被还原,故B错误;
C.电池放电时,根据正极反应:NiO(OH)+H2O+e-=OH-+Ni(OH)2,每转移1mol电子,负极有1molNiO(OH)被还原,故C正确;
D.电池充电时,阳极发生失电子的氧化反应,即为NiO-e-+OH-=NiO(OH),故D正确.
故选CD.
本题解析:
本题难度:一般
4、填空题 氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答

(1)氢氧燃料电池的能量转化主要形式是_______________,在导线中电子流动方向为__________(用a、b表示)。
(2)负极反应式为____________________。
(3)电极表面镀铂粉的原因为______________________。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:?
Ⅰ.2Li+H2 2LiH
2LiH
Ⅱ.LiH+H2O==LiOH+H2↑
①反应Ⅰ中的还原剂是____________,反应Ⅱ中的氧化剂是____________。
②已知LiH固体密度为0.82g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为
____________。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为___________mol。
参考答案:(1)由化学能转化为电能;由a到b
(2)2H2+4OH--4e-==4H2O或H2+2OH--2e-==2H2O
(3)增大电极单位面积吸附H2、O2分子数,加快电极反应速率
(4)①Li;H2O;② 或8.71×10-4;③32
或8.71×10-4;③32
本题解析:
本题难度:困难
5、选择题 汽车的启动电源常用铅蓄电池。其结构如下图所示,放电时其电池反应如下:PbO2+Pb+2H2SO4 2PbSO4+2H2O。下列叙述中正确的是( )
2PbSO4+2H2O。下列叙述中正确的是( )
A.Pb是正极
B.PbO2得电子,被氧化
C.PbO2得电子,被还原
D.电池放电时,溶液酸性增强
参考答案:C
本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。放电相当于原电池,所以根据方程式可知,放电时Pb是负极,失去电子。二氧化铅是正极,得到电子,放电是消耗硫酸的,因此首先降低,所以正确的答案选C。
本题难度:简单