|
|
|
高中化学知识点大全《盐类水解的原理》考点预测(2017年强化版)(十)
2017-07-27 08:32:02
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列溶液中微粒的浓度关于不正确的是
A.NaClO溶液中:c(Na+)= c(ClO-)+ c(HClO)
B.等体积、等物质的量浓度的NaX和弱酸HX混合,所得溶液中:c(Na+)> C(X-)> c(H+)> c(OH-)
C.将25mL0.2mol/L的盐酸与100mL0.1mol/L的氨水混合,所得溶液中:c(NH4+)>c(Cl-)>c(NH3·H2O)> c(OH-)>c(H+)
D.将0.1mol/L的Na2S溶液与0.1mol/L的NaHS溶液等体积混合,所得溶液中:c(Na+)+c(H+)=" 2" c(S2-)+c(HS-)+c(OH-)
|
参考答案:B
本题解析:A、根据物料守恒,则c(Na+)= c(ClO-)+ c(HClO),正确;B、等体积、等物质的量浓度的NaX和弱酸HX混合,溶液若显酸性,则HX的电离程度大于其阴离子的水解程度,则c(Na+)< c(X-),错误;C、将25mL0.2mol/L的盐酸与100mL0.1mol/L的氨水混合,所得溶液为等浓度的氯化铵和氨水的混合液,且溶液呈碱性,一水合氨的电离程度大于铵根离子的水解程度,所以c(NH4+)>c(Cl-)>c(NH3·H2O)> c(OH-)>c(H+),正确;D、将0.1mol/L的Na2S溶液与0.1mol/L的NaHS溶液等体积混合,根据电荷守恒,则有c(Na+)+c(H+)=" 2" c(S2-)+c(HS-)+c(OH-),正确,答案选B。
考点:考查溶液中离子浓度的比较
本题难度:困难
2、实验题 (18分)铵盐在工农业生产中有着重要的用途,请根据要求完成下列各题。
Ⅰ.某化学兴趣小组欲从下列装置中选取必要的装置制取(NH4)2SO4溶液。

(1)仪器连接的顺序(用接口序号字母表示)是:a
(2)试从电离平衡角度分析该实验装置A中能产生氨气的原因:
。
(3)将装置C中两种液体分离开的操作名称是 。
(4)(NH4)2SO4“低毒,有刺激性,有吸湿性、吸湿后固结成块”。储存应注意 。
Ⅱ.为提高氯化铵的经济价值,我国化学家设计了利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁[Mg(OH)Cl]的工艺。某同学根据该原理设计的实验装置如图:

请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为 。
(2)反应过程中持续通入N2的作用有两点:一是使反应产生的氨气完全导出并被稀硫酸充分吸收,
二是 。
(3)由MgCl2溶液蒸发得到MgCl2·6H2O晶体,蒸发的目的是_________。
a.得到热饱和溶液 b.析出晶体
(4)镁是一种用途很广的金属材料,目前世界上60%的镁从 海水中提取。
①若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是:
。
②由MgCl2·6H2O制备无水MgCl2的操作在 氛围中进行,若在空气中加热,则会生成Mg(OH)Cl。
参考答案:(18分)
Ⅰ(1)d e f (2分)
(2)氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡NH3+H2O  NH4++OH—左移,有利氨气逸出。(2分) NH4++OH—左移,有利氨气逸出。(2分)
(3) 分液(2分)。
(4)密封、阴凉、通风(2分)
Ⅱ(1)Mg(OH)2+NH4Cl MgOHCl+NH3↑+H2O(2分) MgOHCl+NH3↑+H2O(2分)
(2)防止装置C中的AlCl3溶液倒吸入装置B(2分)
(3)a(2分)
(4)①用铂丝蘸取少量固体,置于酒精灯火焰上灼烧,若无黄色火焰产生,则证明所得无水氯化镁晶体中不含氯化钠。(2分)(答焰色反应也给分)
②HCl(气流)(2分)
本题解析:Ⅰ(1)制取的氨气与硫酸反应生成硫酸铵,剩余的氨气用水吸收,故连接顺序为a→d→e→f。
(2)氨水中存在电离平衡: NH3+H2O  NH4++OH—,与NaOH混合后,NaOH电离出OH-,促使氨水电离平衡向左移动,有利氨气逸出。 NH4++OH—,与NaOH混合后,NaOH电离出OH-,促使氨水电离平衡向左移动,有利氨气逸出。
(3)分离互不相溶的液体的方法是:分液。
(4)因为(NH4)2SO4“低毒,有刺激性,有吸湿性、吸湿后固结成块”,应防止水分进入,所以储存应注意密封、阴凉、通风。
Ⅱ(1)根据题目所给信息,反应物为Mg(OH)2和NH4Cl,生成物为MgOHCl、NH3和H2O,所以化学方程式为:Mg(OH)2+NH4Cl MgOHCl+NH3↑+H2O。 MgOHCl+NH3↑+H2O。
(2)防止装置C中的AlCl3溶液倒吸入装置B
(3)由MgCl2溶液得到MgCl2·6H2O晶体的方法为蒸发浓缩、降温结晶,所以蒸发的目的是:得到热饱和溶液,故a项正确。
(4)①Na元素用焰色反应进行鉴别,所以操作方法是:用铂丝蘸取少量固体,置于酒精灯火焰上灼烧,若无黄色火焰产生,则证明所得无水氯化镁晶体中不含氯化钠。
②因为MgCl2为强酸弱碱盐,Mg2+发生水解反应,在HCl(气流)中可以抑制MgCl2的水解,所以由MgCl2·6H2O制备无水MgCl2的操作在HCl氛围中进行。
考点:本题考查实验基本操作、实验方案的分析、物质的检验、平衡移动、盐类的水解。
本题难度:困难
3、选择题 下列物质能水解且水解产物有两种的是( ? )
A.麦芽糖
B.蔗糖
C.淀粉
D.纤维素
参考答案:B
本题解析:
本题难度:一般
4、选择题 下列用来表示物质变化的化学用语中,正确的是
A.钢铁发生电化学腐蚀的正极反应式: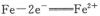
B.HS-的水解方程式:
C.CO32-的水解方程式:
D.AlCl3溶液与Na2CO3溶液混合:
|
参考答案:C
本题解析:A、钢铁发生腐蚀时负极是铁失去电子变成亚铁离子,正极是氧气反应,所以不选A;B、硫氢根离子水解生成硫化氢,所以不选B;C、碳酸根离子水解要分步,第一步水解生成碳酸氢根离子和氢氧根离子,所以选C;D、铝离子和碳酸根离子双水解生成氢氧化铝和二氧化碳,不选D。
考点:离子方程式的判断,盐类的水解。
本题难度:一般
5、选择题 下列有关物质的性质与应用的对应关系正确的是
A.碳酸钠溶液显碱性,用热的碳酸钠溶液可去除金属表面的油污
B.铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸
C.铝的熔点很高,可用于制作耐高温材料
D.浓硫酸具有吸水性,可用于干燥氨气、二氧化碳等气体
参考答案:A
本题解析:A、碳酸钠为强碱弱酸盐,水溶液显碱性,油污在碱性条件下可以发生水解,从而被除去,正确;B、浓硝酸可使金属铝钝化,而浓硝酸可以与金属铜发生氧化还原反应,错误;C、金属铝的熔点是660℃,相对较低,不能用于制作耐高温的材料,可制耐高温材料的是Al2O3,错误;D、浓硫酸具有吸水性,可用于干燥中性或者酸性气体,氨气为碱性气体,不能用浓硫酸干燥,错误;故本题选择A。
考点:盐类的水解,金属的性质,浓硫酸的吸水性
本题难度:一般