| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《盐类水解的原理》考点预测(2017年强化版)(八)
参考答案:B 本题解析:A、同浓度的CaCl2和NaCl溶液中氯离子浓度前者是后者的2倍,故AgCl在同浓度的CaCl2和NaCl溶液中的溶解度前者小于后者,错误;B、pH=4.5的番茄汁中c(H+)=10—4.5,pH=6.5的牛奶中c(H+)=10—6.5,前者是后者的100倍,正确;C、某溶液中由水电离出来的c(H+)和c(OH—)的乘积为1×10—24,该溶液可能呈强酸性,也可能呈强碱性,酸性条件下H+和[Al(OH)4]—反应生成氢氧化铝沉淀或铝离子和水,不能大量共存,错误;D、常温下0.1 mol·L—1 HA溶液的pH>1,则HA为弱酸,0.1 mol·L—1 BOH溶液中c(H+)/c(OH—)=10—12,则BOH为强碱,将这两种溶液等体积混合,混合后溶液为BA强碱弱酸盐溶液,离子浓度的大小关系为:c(B+)>c(A—)>c(OH—)>c(H+),错误。 本题难度:困难 3、选择题 常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通入少量CO2气体生成HX和NaHCO3;往NaY溶液中通入少量CO2生成HY和Na2CO3。下列有关叙述正确的是 |
参考答案:B
本题解析:A.根据复分解反应的规律:强酸制取弱酸,向一元弱酸HX如果向NaX溶液中通入少量CO2气体生成HX和NaHCO3可得酸性H2CO3>HX,向往NaY溶液中通入少量CO2生成HY和Na2CO3则证明酸性HCO3-> HY,则酸性H2CO3>HX>HCO3-> HY,所以选项A错误;酸性越强,其电离产生的离子结合H+的能力就越强,所以结合H+的能力大小关系是:Y->CO32->X->HCO3-,正确;C.酸越强,其盐水解的程度就越小,溶液的碱性就越弱,由于酸性H2CO3>HX>HCO3-> HY,所以溶液碱性:NaY>Na2CO3>NaX>NaHCO3,错误;D.NaX溶液中通入足量CO2后的溶液为NaHCO3和HX。由于盐是强电解质,电离程度大于弱电解质HX,而且HCO3-会发生水解反应消耗水电离产生的H+,使溶液中c(OH-)>c(H+),CO2溶于水反应产生碳酸,即HX电离使溶液显酸性,所以离子浓度:c(Na+)>c(HCO3-)>c(H+)>c(X-)>c(OH-),错误。
考点:考查溶液中离子浓度大小比较的知识。
本题难度:困难
4、选择题 常温下,下列溶液中的微粒浓度关系正确的是
A.氯气通入氢氧化钠溶液中: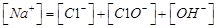
B.pH=8.3的NaHCO3溶液: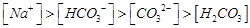
C.pH=11的氨水与pH=3的盐酸等体积混合:
D.某溶液中只存在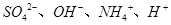 四种离子,则可能存在:
四种离子,则可能存在: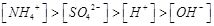
参考答案:D
本题解析:A、氯气通到氢氧化钠中,电荷守恒为[H+]+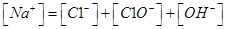 所以不选A;B、碳酸氢钠溶液显碱性,是因为碳酸氢根水解大于电离,所以水解出的碳酸分子浓度大于电离出的碳酸根离子浓度,错误,不选B;C、二者混合后溶液显碱性,即氢氧根离子浓度大于氢离子浓度,不选C;D、若溶质只有硫酸铵时,满足其离子浓度关系,所以正确,选D。
所以不选A;B、碳酸氢钠溶液显碱性,是因为碳酸氢根水解大于电离,所以水解出的碳酸分子浓度大于电离出的碳酸根离子浓度,错误,不选B;C、二者混合后溶液显碱性,即氢氧根离子浓度大于氢离子浓度,不选C;D、若溶质只有硫酸铵时,满足其离子浓度关系,所以正确,选D。
考点:溶液中的离子浓度比较
本题难度:一般
5、填空题 常温下, 浓度均为0. 1 mol/L的6种溶液的pH如下表:
| 序号 | a | b | c | d | e | f |
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | NaAlO2 |
| pH | 8. 8 | 9. 7 | 11. 6 | 10. 3 | 11. 1 | 11. 3 |
参考答案:(1)CH3COO- (2)AlO- +2H2O  Al(OH)3+OH- , NaAlO2
Al(OH)3+OH- , NaAlO2
(3) BE (4)BDE (5)c(Cl- )>c(Na+)>c(Al3+)>c(H+)>c(OH- )
本题解析:
(1)相同浓度的钠盐溶液,pH越小则盐的水解程度越小,阴离子结合H+能力最弱的就是弱酸根对应的酸酸性最强的。酸性强弱CH3COOH>H2CO3>HClO>HCN>HAlO2,所以阴离子结合H+能力最弱的为CH3COO-。
(2)NaAlO2是强碱弱酸盐,AlO-水解使溶液显碱性,AlO- +2H2O Al(OH)3+OH- , NaAlO2水解生成NaOH和Al(OH)3,二者均不易分解和挥发,所以将溶液加热蒸干最后得到的固体产物是NaAlO2。
Al(OH)3+OH- , NaAlO2水解生成NaOH和Al(OH)3,二者均不易分解和挥发,所以将溶液加热蒸干最后得到的固体产物是NaAlO2。
(3)0.1mol/L的CH3OONa溶液,促进水的电离,水电离的c(OH-)=10?14 /10?8.8 =10-5.2mol/L
A.pH=8.8的NaOH溶液,抑制水的电离,水电离的c(H+)=10-8.8mol/L;
B.pH=5.2的NH4Cl溶液,促进水的电离,水电离的c(H+)=10-5.2mol/L;
C.pH=5.2的盐酸,抑制水的电离,水电离的c(OH-)=10?14 /10?5.2 =10-8.8mol/L;
D.0.1mol/L的NaCN溶液,促进水的电离,水电离的c(H+)=10-11.1mol/L;
E.pH=8.8的Na2CO3溶液,促进水的电离,水电离的c(OH-)=10?14 /10?8.8 =10-5.2mol/L;
所以与0.1mol/L的CH3OONa溶液中水的电离程度相同的是:BE;故答案为:BE;
(4)将浓度均为0. 1 mol/L的NaHCO3、Na2CO3等体积混合,混合溶液中粒子之间符合电荷守恒,物料守恒和质子守恒。NaHCO3溶液有物料守恒:c(Na+)=c(CO32-) +c(HCO3-) +c(H2CO3);Na2CO3溶液有c(Na+)=2c(CO32-) +2c(HCO3-) +2c(H2CO3;二式相加即2c(Na+)=3c(CO32-) +3c(HCO3-) +3c(H2CO3;B正确。电荷守恒c(Na+) +c(H+) = 2c(CO32-) +c(HCO3-) +c(OH-)D正确; CO32-水解程度大于HCO3-,溶液呈碱性,所以有c(Na+)>c(HCO3-)> c(CO32-) > c(OH-)> c(H+) ,E正确。
考点:本题考查盐类水解素、化学平衡的影响因素、
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《同分异构体.. | |