微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列三个反应中,过氧化氢所起的作 用是
用是
①H2O2+H2S=2H2O+S↓;②2H2O2=2H2O+O2↑;③H2O2+Cl2=2HCl+O2↑
A.起相同作用
B.只起氧化剂作用
C.起不同作用
D.只起还原剂作用
参考答案:C
本题解析:略
本题难度:一般
2、填空题 在氧化还原反应中,电子转移的表示方法通常用单线桥法和双线桥法。试分析这两种表示方法的特征,并填空。
(1)标单线桥(4分)
KIO3+6HI=KI+3I2+3H2O氧化产物与还原产物物质的量之比=?。
(2)配平化学方程式及标双线桥(5分)
?Fe + ?HNO3(稀)=?Fe(NO3)2+ ?NO↑+ ?H2O反应中,氧化剂与还原剂的物质的量之比?。
参考答案:(1) 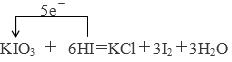 ?5:1
?5:1
(2) ?3?Fe + ?8?HNO3(稀)= ?3 Fe(NO3)2+ ?2 NO↑+ ?4 H2O? 2:3

本题解析:(1)根据方程式KIO3+6HI=KI+3I2+3H2O可知,KIO3中碘元素的化合价从+5价降低到0价,得到5个电子,因此KIO3是氧化剂。HI中碘元素的化合价从-1价升高到0价,失去1个电子,则HI是还原剂,所以根据电子得失守恒可知,还原剂与氧化剂的物质的量之比=5:1,则氧化产物与还原产物物质的量之比=5:1。
(2)根据方程式Fe +HNO3(稀)→Fe(NO3)2+NO↑+ H2O可知,反应中铁元素的化合价从0价升高到+2价失去2个电子。硝酸中氮元素的化合价从+5价降低到+2价得到3个电子,所以根据电子得失守恒可知,还原剂铁与氧化剂硝酸的物质的量之比=3:2,因此根据原子守恒可知,配平后的方程式为3Fe +? 8HNO3(稀)=3Fe(NO3)2+2NO↑+ 4H2O。
本题难度:一般
3、选择题 对于反应14CuSO4+5FeS2+12H2O→7Cu2S+5FeSO4+12H2SO4,下列说法正确的是(?)
A.只有硫酸铜作氧化剂
B.SO42-既不是氧化产物又不是还原产物
C.被氧化的硫与被还原的硫的质量比为3:7
D.1mol硫酸铜可以氧化5/7mol的硫原子
参考答案:C
本题解析:A.FeS2中S元素化合价为-1价,反应后分别升高为+6价、降低为-2价,所以FeS2中S元素部分被氧化,部分被还原,FeS2既是氧化剂又是还原剂,故A错误;B.SO42-是氧化产物,故B错误;C.由化学方程式可知,反应物中含有14molSO42-离子,生成物中有17molSO42-离子,则有3molS被氧化,7molS被还原,故C正确;D.14mol硫酸铜对应的被氧化的硫原子是3mol,故1mol硫酸铜可以氧化3/14mol的硫原子,故D错误.故选:C。
本题难度:一般
4、选择题 将一定量的氯气通入30 mL浓度为10.00 mol·L-1的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是(?)
A.与NaOH反应的氯气一定为0.3 mol
B.n(Na+)∶n(Cl-)可能为7∶3
C.若反应中转移的电子为n mol,则0.15<n<0.25
D.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为11∶2∶1
参考答案:C
本题解析:根据转移电子数计算氯气的物质的量,转移电子数未知导致无法计算氯气的物质的量,故A错误;根据得失电子数相等判断钠离子和氯离子的关系,当n(Na+)∶n(Cl-)为7∶3时,根据阴阳离子所带电荷守恒知,次氯酸根离子和氯酸根离子之和与钠离子之比为4∶7,但氯气和氢氧化钠反应时,得失电子数不相等,故B错误;当n(NaCl)∶n(NaClO)∶n(NaClO3)为11∶2∶1时,得失电子数之比为11∶7,所以不相等,故D错误。
本题难度:一般
5、填空题 抗击“非典”期间,过氧乙酸(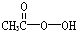 )是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
)是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
① □MnO4+□H2O2+□H+
参考答案:
本题解析:
本题难度:一般