微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。
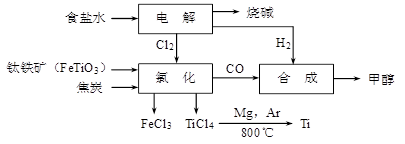
请回答下列问题:
(1)Fe的原子序数为26,其最外层电子数为2,请写出铁原子结构示意图_______。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式 。
(3)氯碱厂获得Cl2的离子方程式为
| TiCl4
| Mg
| MgCl2
| Ti
|
熔点/℃
| -25.0
| 648.8
| 714
| 1667
|
沸点/℃
| 136.4
| 1090
| 1412
| 3287
|
(4)由TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
(5)为了减少产业链生产时产生的工业三废对环境的威胁,当NaCl与FeTiO3的物质的量之比为 时,理论上Cl2的利用率最大。
参考答案:(1)
(2)2FeTiO3+6C+7Cl2高温2FeCl3+2TiCl4+6CO (2分)
(3)2Cl- + 2H2O  H2↑ + Cl2↑ + 2OH-(2分)
H2↑ + Cl2↑ + 2OH-(2分)
(4)1412 (2分)
(5)7:1
本题解析:(1)铁位于元素周期表的第4周期第Ⅷ族,是过渡金属元素的代表,原子序数为26,电子层结构为: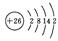
(2)从图示可知氯化时的反应物为FeTiO3、C、Cl2,生成物为FeCl3、TiCl4、CO,再根据得失电子和原子守恒即可得出该反应的方程式为FeTiO3+6C+7Cl2高温2FeCl3+2TiCl4+6CO;
(3)工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业。阳极反应:2Cl--2e-=Cl2↑(氧化反应);阴极反应:2H++2e-=H2↑(还原反应);因此,电解饱和食盐水的总反应可以表示为:2Cl- + 2H2O  H2↑ + Cl2↑ + 2OH-;
H2↑ + Cl2↑ + 2OH-;
(4)Ar气中进行防止钛、镁被氧化;控制温度使TiCl4、Mg、MgCl2转化为蒸气,Ti不熔化,故温度略高于1412℃;
(5)根据2Cl- + 2H2O  H2↑ + Cl2↑ + 2OH-;再根据图示可知氯化时的反应物为FeTiO3、C、Cl2,生成物为FeCl3、TiCl4、CO,再根据得失电子和原子守恒即可得出该反应的方程式为2FeTiO3+6C+
H2↑ + Cl2↑ + 2OH-;再根据图示可知氯化时的反应物为FeTiO3、C、Cl2,生成物为FeCl3、TiCl4、CO,再根据得失电子和原子守恒即可得出该反应的方程式为2FeTiO3+6C+ 2FeCl3+2TiCl4+6CO,得出关系式2FeTiO3 ~ 7Cl2 ~ 14NaCl,所以为了减少产业链生产时产生的工业三废对环境的威胁,当NaCl与FeTiO3的物质的量之比为7:1时,理论上Cl2的利用率最大。
2FeCl3+2TiCl4+6CO,得出关系式2FeTiO3 ~ 7Cl2 ~ 14NaCl,所以为了减少产业链生产时产生的工业三废对环境的威胁,当NaCl与FeTiO3的物质的量之比为7:1时,理论上Cl2的利用率最大。
考点:考查化学工业技术方面知识。
本题难度:困难
2、选择题 有一未完成的离子方程式____+XO3-+6H+=3X2+3H2O,据此判断,氧化产物和还原产物的物质的量之比为
A.1∶1
B.3∶1
C.5∶1
D.7∶1
参考答案:C
本题解析:根据原子守恒和电荷守恒确定空缺的物质为5X-,反应中5X-化合价升高被氧化生成氧化产物5/2X2,XO3-被还原成成还原产物1/2X2,故答案为C。
本题难度:一般
3、选择题 铁粉和铜粉的均匀混合物平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO):
编号
| ①
| ②
| ③
| ④
|
稀硝酸体积/mL
| 100
| 200
| 300
| 400
|
剩余金属/g
| 18.0
| 9.6
| 0
| 0
|
NO体积/mL
| 2240
| 4480
| 6720
| V
|
?
下列计算结果正确的是 (? )
A.①中溶解了5.6gFe? B.硝酸的浓度为0.4mol/L
C.②中溶解了9.6gCu?D.④中V=8960
参考答案:D
本题解析:根据题给数据可知,实验①、②都有金属剩余,则反应后的溶液中不可能含有硝酸铁,溶液中金属离子为亚铁离子和铜离子,实验②是在实验①的基础上加入100mL硝酸,参加反应的金属的质量为8.4g,生成NO的体积为2240mL,物质的量为0.1mol,根据电子转移守恒可知,参加反应金属的物质的量为0.1mol×(5—2)/2=0.15mol,参加反应金属的摩尔质量为56g/mol,该过程只有Fe参加反应,故实验①只有Fe参与反应,根据NO的体积结合方程式计算参加反应Fe的物质的量、硝酸的物质的量,根据m=nM计算参加反应Fe的质量,根据c=nV计算硝酸的物质的量浓度;在实验②的基础上加入100mL硝酸,参加反应的金属的质量为9.6g,生成NO的体积为2240mL,物质的量为0.1mol,若该过程只有Cu参加反应,根据电子转移守恒,则Cu的物质的量0.15mol,Cu的质量9.6g,等于参加反应金属的质量,故该过程只有Cu反应,且Cu恰好完全反应,则加入200mL硝酸时,Fe恰好反应生成硝酸亚铁,在实验③的基础上再加入100mL硝酸,硝酸与溶液中亚铁离子反应生成NO,根据亚铁离子的物质的量,利用电子转移守恒计算该阶段生成NO的物质的量,再根据V=nVm计算该阶段生成NO的体积,进而计算V的值。A、根据上述分析可知,实验①发生反应3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O,生成NO的物质的量为0.1mol,根据方程式可知,参加反应铁的物质的量为0.15mol,质量为8.4g,错误;B、根据上述分析可知,实验①发生反应3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O,生成NO的物质的量为0.1mol,根据方程式可知,参加反应的硝酸的物质的量为0.4mol,故硝酸的物质的量浓度4mol/L,错误;C、由上述分析可知,实验②中参加反应的金属为Fe,Cu没有参加反应,错误;D、由上述分析可知,实验②中Fe与硝酸恰好反应生成硝酸亚铁,生成NO的物质的量0.2mol,由3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O可知,溶液中亚铁离子的物质的量为0.3mol,在实验③的基础上再加入100mL硝酸,为硝酸与溶液中亚铁离子反应生成NO,根据电子转移守恒可知,生成NO的物质的量0.1mol,体积为2240mL,V=6720+2240=8960,正确。
本题难度:一般
4、填空题 钛及其合金具有密度小,强度高,耐腐蚀等优良性能,被广泛用于航天、航空、航海、石油化工、医药等部门,因此,钛被誉为第三金属和战略金属。从铁钛矿提取金属钛(海绵钛)的主要工艺过程如下:
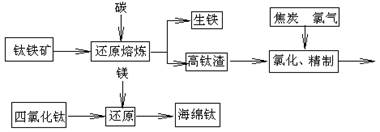
(1)钛铁矿的主要成分是FeTiO3,第一步发生的反应:FeTiO3+C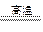 TiO2+Fe+CO↑,在FeTiO3(钛酸亚铁)中,钛的化合价为?。
TiO2+Fe+CO↑,在FeTiO3(钛酸亚铁)中,钛的化合价为?。
(2)第二步:二氧化钛在高温下与焦炭、氯气反应生成四氯化钛和一氧化碳,写出化学方程式:?,还原产物是?。
(3)用镁在高温下还原四氯化钛,该反应的环境要求是?;写出化学方程式?。
(4)菱镁矿(主要成分是碳酸镁)煅烧后与焦炭混合在氯化器中高温下通入氯气生成氯化镁,电解熔融氯化镁得到镁。
①写出菱镁矿煅烧及氯化制取氯化镁的化学方程式:?;
②写出电解熔融氯化镁的电解方程式?。
参考答案:
(1)+4价?(2)TiO2+2C+2Cl2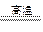 TiCl4+2CO?四氯化钛? (3)惰性气体保护? 2Mg+TiCl4
TiCl4+2CO?四氯化钛? (3)惰性气体保护? 2Mg+TiCl4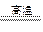 2MgCl2+Ti?
2MgCl2+Ti?
(4)①MgCO3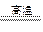 MgO+CO2↑,MgO+Cl2+C
MgO+CO2↑,MgO+Cl2+C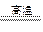 MgCl2+CO;②MgCl2
MgCl2+CO;②MgCl2 Mg+Cl2↑
Mg+Cl2↑
本题解析:(1)根据钛酸亚铁名称知,铁呈+2价,从反应式看,得失电子总数相等,说明钛化合价没有变,即钛呈+4价。(2)根据反应物和产物写化学方程式,注意配平。(3)高温下镁和钛都易与空气中氧气反应,故要在保护气中还原钛,不能用二氧化碳和氮气作保护气,因为镁能与二氧化碳和氮气反应。用惰性气体作保护气,如氩气等。(4)碳酸镁分解类似碳酸钙,在氯气作用下焦炭还原氧化镁生成氯化镁和一氧化碳。电解熔融氯化镁生成镁和氯气,初中教材中出现了电解水,高中介绍了用电解法冶炼镁、铝、钠等活泼金属。
本题难度:一般
5、填空题 (16分) 以电解法生产金属锰产生的阳极泥中,其锰含量高达40%~50%,主要成分为MnO2的水合物,且含有显著量的Pb2+、Sn2+等重金属杂质。本工艺采用的木屑富含的纤维素在较浓硫酸的作用下膨胀、水解生成还原糖,酸性条件下,可与二氧化锰反应生成可溶性的硫酸锰。

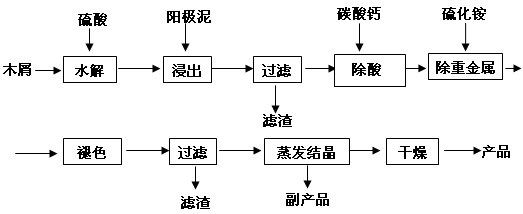
(1)工业上电解硫酸锰的水溶液生产金属锰,阳极的电极反应式为 。
(2)写出木屑水解反应的化学方程式: 。配平浸出步骤反应方程式C6H12O6 + MnO2 + H2SO4→ MnSO4 + CO2 + H2O
(3)若取消除酸操作步骤,将会产生 气体(填化学式)而污染环境;
(4)本工艺的一种副产品是重要的农业生产资料,写出其化学式 ;
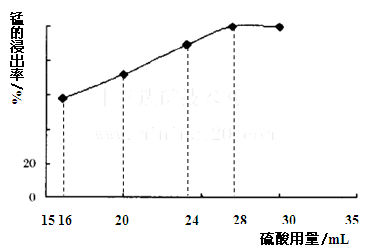
(5)取一定量的阳极泥进行实验分析,得到如下图像。硫酸的最合适用量为 mL,若再增加硫酸的用量,将会导致 (填化学式)的消耗量增大。
(6)某阳极泥中MnO2(相对分子质量为87)的质量分数为50.0%,将174g该阳极泥与320g36.5%的浓盐酸混合加热,则产生的氯气在标准状况下应少于 L。(假设阳极泥中的其它成分不参与反应)
参考答案:(1)4OH- -4e-=O2 + 2H2O 或2H2O
本题解析:
本题难度:困难