微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10)为比较铜与锌的金属活动性相对强弱,甲、乙、丙三位同学用中学化学常见的药品和仪器(用品),设计了下列实验。试回答下列问题:
(1)甲同学将锌插入CuSO4溶液中,结果锌片的表面析出一层红色的物质,该反应的离子方程式为?。
(2)乙同学将铜片和锌片插入同一个盛有稀H2SO4的烧杯中(铜片和锌片不接触),观察到的现象是?
(3)丙同学接着乙同学的实验,用导线将铜片和锌片连接起来组成原电池,此时作电池正板的是?,负极的电板反应式为?
(4)甲、乙、丙三位同学所设计的实验中能达到比较铜和锌的金属活动性相对强弱的实验目的的是?(填字母)。
A.只有甲同学
B.甲和乙同学
C.乙和丙同学
D.甲,乙和丙同学
参考答案:(1)Zn+Cu2+=Cu+Zn2+?
(2)锌片表面产生大量气泡,锌片逐渐溶解,铜片表面无明显现象
(3)铜片,Zn-2e- =Zn2+? (4) D
本题解析:(1)锌比铜活泼,可将铜从其盐溶液中置换出来。
(2)在金属活动顺序表只锌排在氢的前面,铜排在氢的后面,所以锌能和酸反应置换出氢气,而铜不能。
(3)若用导线连接,则构成铜锌原电池,铜是正极,锌是负价,失去电子被氧化。
(4)根据实验现象,3位学生的实验均能达到比较铜和锌的金属活动性相对强弱。
本题难度:一般
2、选择题 原电池产生电流的本质原因是
[? ]
A.原电池中溶液能电离出自由移动的离子
B.有两根导线将两个活泼性不同的电极连接
C.电极上进行的氧化还原反应的生成物为电子
D.电极上进行的氧化还原反应中发生了电子的转移
参考答案:D
本题解析:
本题难度:简单
3、填空题 (8分)
如图所示,是原电池的装置图( 为电流表)。请回答:
为电流表)。请回答:
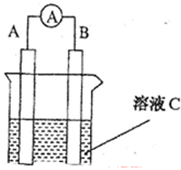
(1)若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Fe且做负极,则A电极上发生的电极反应式为 ;反应进行一段时间后溶液C的pH将 (填“升高”“降低”或“基本不变”)。
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成如上图所示的原电池装置,则A(负极)极材料为 ,B(正极)极材料为 ,溶液C为 。
(3)若C为NaOH溶液,A电极材料为Al,B电极材料为Mg,负极上发生的电极反式为 。
参考答案:(1)2H++2e-==H2↑;升高
(2)Cu 石墨(合理即可) FeCl3溶液;
(3)Al-3e-+4OH-=AlO-2+2H2O.
本题解析:(1)铁作负极,则该原电池反应是铁与稀硫酸置换氢气的反应,所以正极反应是氢离子得电子生成氢气,电极反应式为2H++2e-==H2↑;溶液中氢离子放电,导致溶液中氢离子浓度减小,pH升高;
(2)Cu+2Fe3+=Cu2++2Fe2+设计成如上图所示的原电池装置,根据方程式中物质发生的反应类型判断,Cu发生氧化反应,作原电池的负极,所以A材料是Cu,B极材料是比Cu不活泼的导电物质如石墨、Ag等即可。溶液C中含有Fe3+,如FeCl3溶液;
(3)若C为NaOH溶液,A电极材料为Al,B电极材料为Mg,则Al与氢氧化钠溶液反应,则Al作负极,电极反应式为Al-3e-+4OH-=AlO-2+2H2O.
考点:考查对原电池反应原理的应用,电极的判断,电解质溶液的选择,电极反应式的书写
本题难度:困难
4、选择题 一种新型熔融盐燃料电池具有高发电效率.现用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2混合气体,其总反应为:2CO+O2==2CO2.则下列说法中正确的是
[? ]
A.通CO的一极是电池的正极
B.负极发生的电极反应是:O2+2CO2+4e-===2CO32-
C.负极发生的电极反应是:CO+CO32--2e-===2CO2
D.正极发生氧化反应
参考答案:C
本题解析:
本题难度:一般
5、选择题 下列叙述中,正确的是?(?)
A.在船舶的外壳装上铜块可防止其发生电化学腐蚀
B.MnO2、FeCl3和CuSO4都可加快H2O2的分解速率
C.FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3
D.用惰性电极分别电解CuCl2溶液和MgCl2溶液分别得到单质Cu和Mg
参考答案:B
本题解析:略
本题难度:一般