微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列互为同位素的是(? )
A.Na和Na+
B.35Cl 和37Cl
C.14N 和14C
D.O2和O3
参考答案:B
本题解析:同位素是指质子数相同而中子数不同的同一元素的不同原子互称同位素,正确选项为B;
本题难度:简单
2、选择题 中学化学教材中有大量数据,下列为某同学对数据的利用情况,其中错误的是
A.用溶解度数据判断煮沸Mg (HCO3)2溶液得到的产物是Mg(OH)2而不是 MgCO3
B.用沸点数据推测将一些液体混合物用分馏的方法分离开来的可能性
C.利用溶液的pH与7的大小关系,来判断任何温度下溶液的酸碱性
D.用原子(或离子)半径数据推断某些原子(或离子)氧化性或还原性的强弱
参考答案:C
本题解析:
答案:C
A.正确,用溶解度数据:Mg(OH)2的溶解度小于MgCO3,判断煮沸Mg(HCO3)2溶液得到的产物是Mg(OH)2而不是 MgCO3
B.正确,用沸点数据:两种液态物质的沸点差大于30℃时,用分馏的方法分离一些液体混合物
C.不正确,利用溶液中OH―和H+ 浓度的相对大小关系,来判断任何温度下溶液的酸碱性
D.正确,半径小,对外围电子的吸引力大,用原子(或离子)半径数据推断某些原子(或离子)氧化性或还原性的强弱。
本题难度:一般
3、选择题 日本大地震引发福岛核电站核泄漏事故,造成含131I和137Cs的放射性物质向外界泄露,下列有关说法错误的是(?)
A.137Cs的原子有82个中子
B.CsOH的碱性比KOH的碱性强
C.KIO3是碘的最高价氧化物对应水化物的盐
D.HI的还原性比HF强
参考答案:C
本题解析:
答案:C
A.正确,137Cs的原子有:137-55=82个中子;B.正确,Cs原子半径大,CsOH的碱性比KOH的碱性强; C.不正确,碘的最高价为+7价,KIO4是碘的最高价氧化物对应水化物的盐;D.正确,碘原半径大,对核外电子引力小,HI的还原性比HF强
本题难度:一般
4、填空题 (12分)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
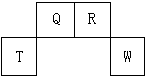
(1)W在周期表中的位置是_________________, Q、R、T三种元素原子的半径从大到小排列顺序__________ (用元素符号表示),Q的最高价氧化物的电子式_____________,R气态氢化物分子的结构式为_____________。
(2)元素的原子得电子能力:Q______W(填“强于”或“弱于”)。
(3)原子序数比R多8的元素形成的一种常见气态氢化物的沸点?(填“高”或“低”)于R的的常见气态氢化物。
(4)T、Q、R、W的单质中,固态时属于原子晶体的是_____________(填名称)。
(5)现有8种元素的性质、数据如下表所列,它们属于短周期:请指出R元素在上表中的对应编号__________,与T同周期且最高价氧化物的水化物碱性最强的元素在上表中的对应编号____________,编号为⑥的最高价氧化物的水化物的电子式?。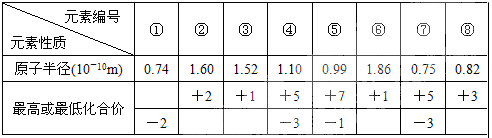
参考答案:(1)第三周期VIA族? Al>C>N?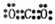 ?
?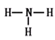
(2)弱于?(3)低?(4)金刚石(5)⑦?⑥?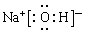
本题解析:考查元素周期表的结构和元素周期律的应用。根据元素在周期表中的位置可知,T属于第三周期,T所处的周期序数与主族序数相等,所以T是铝。则Q是C,R是N,W是S。
(1)同周期元素自左向右原子半径逐渐减小,同主族元素自上而下原子半径逐渐增大。所以原子半径是铝>碳>氮。CO2和NH3均是由极性键形成的共价化合物,其电子式和结构式分别为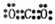 、
、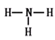 。
。
(2)非金属性越强,越容易得到电子,所以碳原子的得电子能力弱于硫原子的。
(3)原子序数比R多8的元素是P,其氢化物的沸点要低于氨气的,因为氨气中存在氢键。
(4)碳的同素异形体中的金刚石属于原子晶体。
(5)N属于第二周期第ⅤA,最高价是+5价,最低价是-3价,在该族中氮原子的半径最小,所以是⑦。与T同周期且最高价氧化物的水化物碱性最强的元素是Na,最高价是+1价,没有负价,且在同周期中钠原子半径增大,所以是⑥。编号为⑥的最高价氧化物的水化物是氢氧化钠,所以离子化合物,但还含有极性键,电子式为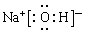 。
。
本题难度:一般
5、选择题 某主族元素最外层只有1个电子,则该元素一定是(?)
A.ⅠA族元素
B.第ⅦA元素
C.第三周期元素
D.金属元素
参考答案:A
本题解析:主族元素最外层只有1个电子,则该元素一定是第IA,第IA含有氢,氢是非金属,答案选A。
本题难度:一般