| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《化学平衡》答题技巧(2017年最新版)(二)
参考答案:A 本题解析:A. NO2是红棕色气体,N2O4是无色气体。气体颜色越深,透光率越小。由于从b点到c点透光率减小,说明进行的存在的操作是压缩注射器,使气体的体积减小,气体的浓度增大,正确;B. 向里推注射器,使容器的容积减小,物质的浓度与压缩前比都增大,错误;C. 根据平衡移动原理:增大压强,平衡向气体体积减小的方向移动,对该反应来说,气体体积减小的方向是放热反应,所以若不忽略体系温度变化,且没有能量损失,则T(b)<T(c),错误;D. 从图像可以看出在d 点后物质的透光率逐渐减小,说明平衡逆向移动,所以:v(正)<v(逆),错误。 本题难度:一般 2、选择题 在一定条件下,对于反应mA(g)+nB(g) |
参考答案:A
本题解析:从图中可看出,升温时,C%减小,说明平衡左移,正反应为放热反应,△H<0;
在等温条件下,加压,C%减小,平衡左移,说明正反应是气体系数增大的反应,△S>0
故答案为A
本题难度:一般
3、选择题 一定温度下将1molSO3放入2L的反应器内,当反应:2SO3(g) 2SO2(g)+O2(g)平衡时,容器内有0.6molSO2,其平衡常数约是( ? )
2SO2(g)+O2(g)平衡时,容器内有0.6molSO2,其平衡常数约是( ? )
A.0.68
B.0.34
C.0.45
D.0.47
参考答案:B
本题解析:
本题难度:一般
4、选择题 某温度下,在固定容积的容器中,可逆反应A(g)+3B(g)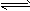 2C(g)达到平衡,若保持温度不变,以平衡时反应混合物中A、B、C的比例向该容器中再充入一定量的A、B、C,下列叙述正确的是
2C(g)达到平衡,若保持温度不变,以平衡时反应混合物中A、B、C的比例向该容器中再充入一定量的A、B、C,下列叙述正确的是
[? ]
A.刚充入时反应速率v正减少,v逆增大
B.平衡不发生移动
C.平衡向逆反应方向移动
D.物质C的质量分数增大
参考答案:D
本题解析:
本题难度:一般
5、选择题 N2(g)+3H2(g) 2NH3(g) +92.4 kJ。恒容时,体系中各物质浓度随时间变化的曲线如图示。下列说法错误的是
2NH3(g) +92.4 kJ。恒容时,体系中各物质浓度随时间变化的曲线如图示。下列说法错误的是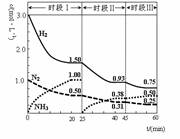
A.前20分钟反应内放出的热量为46.2kJ
B.第25分钟改变的条件是将NH3从反应体系中分离出去
C.若第60分钟时反应又达到了平衡,则时段Ⅲ改变的条件是增大压强
D.时段Ⅰ仅将初始投放的物质浓度增至原来的2倍,则反应物的转化率增大,平衡常数不变
参考答案:AC
本题解析:A.由于不知道溶液的体积无法知道反应的量无法计算放出的热量,故A错误;B.第Ⅱ阶段氨气是从0开始的,瞬间A、B浓度不变,因此可以确定第一次平衡后从体系中移出了C,即减少生成物浓度,平衡正向移动,故B正确;C.第Ⅲ阶段的开始与第Ⅱ阶段的平衡各物质的量均相等,根据A、B的量减少,C的量增加可判断平衡是正向移动的,根据题目所给条件容器的体积不变,则改变压强也不可能,因此一定为温度的影响,此反应正向为放热反应,可以推测为降低温度,因此达到平衡后温度一定比第Ⅱ阶段平衡时的温度低,故C错误;D.D中条件的改变相当于增大了压强,平衡常数仅与温度有关不受压强的影响,正确;故选AC。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《化学反应与.. | |