微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g)  Y(g)+Z(s),以下能说明反应达到平衡标志的(?)
Y(g)+Z(s),以下能说明反应达到平衡标志的(?)
A.混合气体的压强不再变化
B.X、Y、Z的物质的量之比为2:1:1
C.单位时间内生成lmolY的同时分解2mol X
D.X的分解速率与Y的消耗速率相等
参考答案:A
本题解析:在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,因此选项B不正确。根据反应式可知,反应前后体积是减小的,所以压强也是减小的,因此选项A能说明;选项C中反应速率的方向相同,不能说明。选项D中反应速率的方向相反,但不能满足反应速率之比是相应的化学计量数之比,因此正确的答案选A。
本题难度:一般
2、选择题 能证明反应:H2(g)+ I2(g)  2HI(g)已经达到平衡状态的是
2HI(g)已经达到平衡状态的是
①c(H2):c(I2):c(HI)=1:1:2
②单位时间内生成nmolH2的同时消耗nmolI2
③反应速率2v(H2)=2v(I2)= v(HI)
④温度和体积一定时,容器内压强不再变化
⑤温度和压强一定时,混合气体的密度不再变化
⑥温度和体积一定时,混合气体的颜色不再变化
A.①③
B.②⑥
C.③⑥
D.④⑤
参考答案:B
本题解析:①不能,浓度不再改变才是标志。②可以推出正反应速率等于逆反应速率,是达平衡的标志。③没有说明是正反应速率还是逆反应速率。④本方程反应前后体积不变,所以压强不是标志。⑤本方程反应前后有质量守恒,而体积也不变,所以密度不变,不能作为判断标志。⑥可以作为标志。
点评:本题考查的方程式有一个特殊点,反应前后的计量数之和相等,即反应前后体积不变,这是判断此题的关键。
本题难度:一般
3、选择题 对于可逆反应A(g)+2B(g)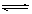 2C(g) ?ΔH >0,下列图象中正确的是
2C(g) ?ΔH >0,下列图象中正确的是
参考答案: D
D
本题解析:该反应是体积减小的、吸热的可逆反应。所以增大压强平衡向正反应方向移动,A不正确。升高温度平衡也向正反应方向移动,B不正确。温度越高反应速率越快,到达平衡的时间就越短,C不正确。升高温度平衡向正反应方向移动,生成物的含量降低,即选项D是正确的,所以答案选D。
本题难度:一般
4、选择题 一定条件下,在容积为10L的密闭容器中,将l mol X和1 mol Y进行如下反应:2X(g)+Y(g)  Z(g),经60 s达到平衡生成0.3 mol的Z,下列说法正确的是
Z(g),经60 s达到平衡生成0.3 mol的Z,下列说法正确的是
A.60 s时Z的平衡浓度为0.03 mol/L
B.将容器容积变为20 L,Z的新平衡浓度将等于原平衡浓度的一半
C.若温度和体积不变,往容器内增加1 mol N2,压强增大,Y的转化率将增大
D.若升高温度,X的体积分数增大,则正反应的△H>0
参考答案:A
本题解析:
2X(g)+Y(g)  Z(g)
Z(g)
起始量(mol)?1? 1? 0
转化量(mol)?0.6? 0.3? 0.3
平衡量(mol)?0.4? 0.7? 0.3
保持温度和体积不变,增加X的浓度,可以提高其它反应物的转化率,但自身转化率会降低。因为反应是体积减小的可逆反应,当容器体积变为20L时,体系内压强降低,平衡向逆反应方向移动,所以Z的新平衡浓度将小于原平衡浓度的1/2。升高温度,X的体积分数增大,说明平衡向逆反应方向移动,因此正反应是放热反应。所以正确的答案是A。
本题难度:简单
5、选择题 在一定条件下,可逆反应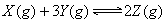 达到平衡时,测得Y的转化率为37.5%,X的转化率为25%,则反应开始时,充入容器中的X、Y的物质的量之比是
达到平衡时,测得Y的转化率为37.5%,X的转化率为25%,则反应开始时,充入容器中的X、Y的物质的量之比是
[? ]
A.1:3
B.3:1
C.3:2
D.1:2
参考答案:D
本题解析:
本题难度:简单