微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 有人研究了340 K时N2O5的分解反应:2N2O5=4NO2+O2,所得实验数据(各种物质在不同时刻的浓度)见下表。

(1)图象能够非常直观地描述物理量的变化趋势。请你在下图中分别作出c(N2O5)-t图象及c(O2)-t图象,描述反应物、生成物的浓度与反应时间的关系。
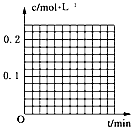
(2)数据处理是化学实验过程中非常重要的一个环节。请按下式计算化学反应速率,并将计算结果填入表中。 

(3)根据计算结果寻找用各物质表示的化学反应速率之间的关系。
参考答案:
(1)
(2)
(3)用各物质表示的化学反应速率之比等于化学方程式中各物质的化学计量数之比。
本题解析:
本题难度:一般
2、选择题 反应4NH3+5O2?4NO+6H2O在5L的密闭容器中进行30s后,NO的物质的量增加了0.3mol,则此反应的平均速率为( )
A.v(O2)=0.01?mol?L-1?s-1
B.v(NO)=0.008?mol?L-1?s-1
C.v(H2O)=0.003?mol?L-1?s-1
D.v(NH3)=0.002?mol?L-1?s-1
参考答案:在5L的密闭容器中进行30s后,NO的物质的量增加了0.3mol,则v(NO)=0.3mol5L30s=0.002mol/(L?min).
A、速率之比等于化学计量数之比,所以v(O2)=54v(NO)=54×0.002mol/(L?min)=0.0025mol/(L?min),故A错误;
B、v(NO)=0.002mol/(L?min),故B错误;
C、速率之比等于化学计量数之比,所以v(H2O)=32v(NO)=32×0.002mol/(L?min)=0.003mol/(L?min),故C正确;
D、速率之比等于化学计量数之比,所以v(NH3)=v(NO)=0.002mol/(L?min),故D正确.
故选CD.
本题解析:
本题难度:简单
3、选择题 恒温、恒压下,a mol A和b mol B在一个容积可变的容器中发生如下反应:
A(g)+2B(g) 2C(g)
2C(g)
一段时间后达到平衡,生成n mol C。则下列说法正确的是(?)
A.物质A、B的转化率之比为a∶b
B.起始时刻和达平衡后容器中的压强比为(a+b)∶(a+b-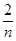 )
)
C.若起始时放入2a mol A和2b mol B,则达平衡时生成2n mol C
D.当v正(A)=2v逆(B)时,可确定反应达平衡
参考答案:C
本题解析:生成n mol C参加反应的A、B的物质的量分别为n/2 mol,n mol,转化率之比为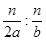 =
=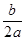 ;恒压过程,压强之比为1∶1;恒压过程成倍地增大反应物的量,则平衡时C的量也成倍地增加;反应速率之比等于化学计量数比,当2v正(A)=v逆(B)时,可确定反应达到平衡。
;恒压过程,压强之比为1∶1;恒压过程成倍地增大反应物的量,则平衡时C的量也成倍地增加;反应速率之比等于化学计量数比,当2v正(A)=v逆(B)时,可确定反应达到平衡。
本题难度:简单
4、选择题 在2CH4+2NH3+3O2=2HCN+6H2O反应中,同一时间内测得v(O2)为b?mol·L-1·min-1?,v(HCN)为a?mol·L-1·min-1?,则a与b的关系为
A.b =1/2 a
B.b =2/3 a
C.b =3/2 a
D.b =2 a
参考答案:C
本题解析:正确答案:C速率之比等于方程式的计量数之比,a与b之比为2:3,C正确。
本题难度:困难
5、填空题 化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:
TaS2(s)+2I2(g) TaI4(g)+S2(g) ΔH>0(I)
TaI4(g)+S2(g) ΔH>0(I)
反应(Ⅰ)的平衡常数表达式K=________,若K=1,向某恒容容器中加入1 mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为________。
(2)如图所示,反应(Ⅰ)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净TaS2晶体,则温度T1________T2(填“>”“<”或“=”)。上述反应体系中循环使用的物质是________。
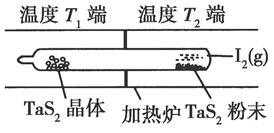
(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为________,滴定反应的离子方程式为______________________。
(4)25℃时,H2SO3 HSO3-+H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kh=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中
HSO3-+H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kh=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中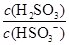 将________(填“增大”“减小”或“不变”)。
将________(填“增大”“减小”或“不变”)。
参考答案:(1)[c(TaI4)·c(S2)]/c2(I2) 66.7% (2)< I2 (3)淀粉 I2+H2SO3+H2O=4H++2I-+SO42-
(4)1×10-12 增大
本题解析:结合题给可逆反应的特点,应用化学平衡移动原理,分析化学平衡、电离平衡和水解平衡问题。
(1)反应(Ⅰ)中,TaS2为固体,则平衡常数表达式K=[c(TaI4)·c(S2)/c2(I2)]。设平衡时,I2转化的物质的量为x,则有
TaS2(s)+2I2(g) TaI4(g)+S2(g)
TaI4(g)+S2(g)
起始/mol?1?0?0
转化/mol ?x?0.5x?0.5x
平衡/mol?1-x ?0.5x ?0.5x
此时平衡常数K为1,则有[(0.5x)·(0.5x)]/(1-x)2=1,从而可得x=2/3 mol,I2(g)的转化率为(2/3 mol)/1 mol×100%≈66.7%。
(2)由题意可知,未提纯的TaS2粉末变成纯净TaS2晶体,要经过两步转化:①TaS2+2I2=TaI4+S2,②TaI4+S2=TaS2+2I2,即反应(Ⅰ)先在温度T2端正向进行,后在温度T1端逆向进行,反应(Ⅰ)的ΔH大于0,因此温度T1小于T2,该过程中循环使用的是I2。
(3)淀粉遇单质I2显蓝色,利用I2溶液滴定H2SO3时,常用淀粉作指示剂,达到终点时,溶液由无色变成蓝色,滴定反应的离子方程式为I2+H2SO3+H2O=4H++2I-+SO42-。
(4)H2SO3的电离常数Ka=[c(HSO3-)·c(H+)]/c(H2SO3)=1×10-2 mol·L-1,水的离子积常数KW=c(H+)·c(OH-)=1×10-14mol2·L-2,综上可得Ka=[c(HSO3-)·KW]/[c(H2SO3)·c(OH-)]。NaHSO3溶液中HSO3-的水解反应为HSO3-+H2O H2SO3+OH-,则水解平衡常数Kh=[c(H2SO3)·c(OH-)]/c(HSO3-)=KW/Ka=(1×10-14mol2·L-2)/(1×10-2mol·L-1)=1×10-12mol·L-1。NaHSO3溶液中加入少量I2,二者发生氧化还原反应,溶液中c(HSO3-)减小,HSO3-的水解程度增大,c(H2SO3)/c(HSO3-)将增大。
H2SO3+OH-,则水解平衡常数Kh=[c(H2SO3)·c(OH-)]/c(HSO3-)=KW/Ka=(1×10-14mol2·L-2)/(1×10-2mol·L-1)=1×10-12mol·L-1。NaHSO3溶液中加入少量I2,二者发生氧化还原反应,溶液中c(HSO3-)减小,HSO3-的水解程度增大,c(H2SO3)/c(HSO3-)将增大。
点拨:知识:平衡常数及转化率;平衡移动及影响因素;氧化还原滴定及指示剂的选择;电离平衡常数和水解平衡常数的计算。能力:考查考生的综合应用能力、分析问题和解决问题的能力,以及简单计算的能力。试题难度:较大。
本题难度:一般