微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (15分)随着氮氧化物污染的日趋严重,国家将于“十二五”期间加大对氮氧化物排放的控制力度。目前,消除氮氧化物污染有多种方法。
(1)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g)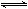 N2(g)+CO2 (g) △H。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2 (g) △H。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol·L-1
时间/min
| NO
| N2
| CO2
|
0
| 0.100
| 0
| 0
|
10
| 0.058
| 0.021
| 0.021
|
20
| 0.040
| 0.030
| 0.030
|
30
| 0.040
| 0.030
| 0.030
|
40
| 0.032
| 0.034
| 0.017
|
50
| 0.032
| 0.034
| 0.017
|
①T1℃时,该反应的平衡常数K=?(保留两位小数)。
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是?。
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H?0(填“>”、“ =”或“<”)。
(2)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)?△H=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)?△H=-1160 kJ·mol-1
③H2O(g)=H2O(l)?△H=-44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式?。
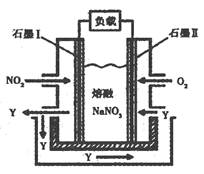
(3)以NO2、O2、熔融NaNO3组成的燃料电池装置如图所示,在使用过程中石墨I电极反应生成一种氧化物Y,有关电极反应可表示为?。
2、填空题 (10分)计算填空:
(1)(2分)1mol某金属单质与足量的H2SO4反应,放出1.5molH2(标况下)并转化为具有Ne原子的电子层结构的离子,则该金属在周期表的位置?。
(2)(6 分)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下:
_? aA (g)+ bB (g)  2C(g)
2C(g)
起始物质的量(mol):? 3? 2? 0
2s末物质的量浓度(mol/L): 0.9? 0.8? 0.4
则①a=?,b=?;
②2S内B的反应速率=?。
(3)(2分) 1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式?。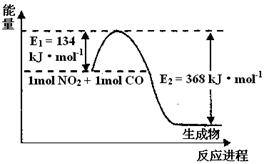
3、选择题 在一定温度下,向体积恒定为2 L的密闭容器里充入2 mol M和一定量的N,发生如下?反应:M(g)+N(g) E(g)。当反应进行到4min时达到平衡,测得M的浓度为0.2 mol·L-1。下列说法正确的是
E(g)。当反应进行到4min时达到平衡,测得M的浓度为0.2 mol·L-1。下列说法正确的是
A.4 min时,M的转化率为80%
B.4 min时,用M表示的反应速率为0.8 mol·L-1·min-1
C.4 min后,向容器中充入不参与反应的稀有气体,M的物质的量减小
D.2 min时,M的物质的量浓度为0.6 mol·L-1
4、填空题 液氨常用作制冷剂,回答下列问题
(1)一定条件下在密闭容器中发生反应:
a.NH4I(s)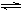 NH3(g) + HI(g)? b.2HI(g)
NH3(g) + HI(g)? b.2HI(g) 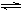 ?H2(g) + I2(g)
?H2(g) + I2(g)
①写出反应a的平衡常数表达式?
②达到平衡后,扩大容器体积,反应b的移动方向?(填“正向”、“逆向”或“不移动”),达到新的平衡时容器内颜色将怎样变化?(填“加深”、“变浅”或“不变”)
(2)工业上合成氨的反应:N2(g)+3H2(g) 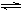 2NH3(g) ?ΔH=-92.60 kJ·mol-1
2NH3(g) ?ΔH=-92.60 kJ·mol-1
下列说法能说明上述反应向正反应方向进行的是________(填序号)。
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N—H键的同时生成2n mol H—H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
d.混合气体的平均摩尔质量增大
e.容器内的气体密度不变
(3)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据:
?时间(h)
物质的量(mol)
| 0
| 1
| 2
| 3
| 4
|
N2
| 1.50
| n1
| 1.20
| n3
| 1.00
|
H2
| 4.50
| 4.20
| 3.60
| n4
| 3.00
|
NH3
| 0
| 0.20
| ?
| 1.00
| 1.00
|
?
根据表中数据计算:
①反应进行到2 h时放出的热量为________ kJ。
②0~1 h内N2的平均反应速率为________ mol·L-1·h-1。
③此温度下该反应的化学平衡常数K=________(保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00 mol,化学平衡将向________方向移动(填“正反应”或“逆反应”)。
(4)肼(N2H4)的性质类似于NH3,极易溶于水,与水反应生成一种二元弱碱在溶液中分步电离,请用离子反应方程式表示其水溶液显碱性的原因?
5、选择题 在一定温度下,反应1/2H2(g)+ 1/2X2(g) 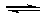 HX(g)的平衡常数为10。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于
HX(g)的平衡常数为10。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于

A.5%
B.17%
C.25%
D.33%