微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (15分)随着氮氧化物污染的日趋严重,国家将于“十二五”期间加大对氮氧化物排放的控制力度。目前,消除氮氧化物污染有多种方法。
(1)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2(g)+CO2 (g) △H。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2 (g) △H。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol·L-1
时间/min
| NO
| N2
| CO2
|
0
| 0.100
| 0
| 0
|
10
| 0.058
| 0.021
| 0.021
|
20
| 0.040
| 0.030
| 0.030
|
30
| 0.040
| 0.030
| 0.030
|
40
| 0.032
| 0.034
| 0.017
|
50
| 0.032
| 0.034
| 0.017
|
①T1℃时,该反应的平衡常数K=?(保留两位小数)。
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是?。
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H?0(填“>”、“ =”或“<”)。
(2)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)?△H=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)?△H=-1160 kJ·mol-1
③H2O(g)=H2O(l)?△H=-44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式?。
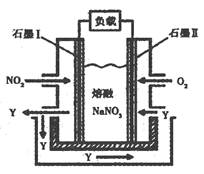
(3)以NO2、O2、熔融NaNO3组成的燃料电池装置如图所示,在使用过程中石墨I电极反应生成一种氧化物Y,有关电极反应可表示为?。
参考答案:(1)①0.56?②减小CO2的浓度(合理答案均可)?③<
(2)CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)?△H=-955 kJ·mol-1
(3)NO2+NO3--e-=N2O5
本题解析:(1)①根据表中数据可知,反应进行到20min是气体物质的浓度不再发生变化,所以平衡常数=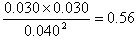
②30min→4min时NO和CO2浓度减小,氮气的浓度增大,所以改变的条件是减小CO2的浓度。
③容器中NO、N2、CO2的浓度之比为5:3:3,说明升高温度反应物的浓度增大,因此反应向逆反应方向移动,即正反应是放热反应。
(2)考查盖斯定律的应用,(①+②)÷2+③×2即得到CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l),所以反应热是(-574 kJ·mol-1-1160 kJ·mol-1)÷2-44.0 kJ·mol-1×2=-955 kJ·mol-1。
(3)根据装置图可知,Y是在石墨I生成的,而石墨I通入的是NO2,所以是负极,失去电子,因此反应式为NO2+NO3--e-=N2O5。
本题难度:一般
2、填空题 (10分)计算填空:
(1)(2分)1mol某金属单质与足量的H2SO4反应,放出1.5molH2(标况下)并转化为具有Ne原子的电子层结构的离子,则该金属在周期表的位置?。
(2)(6 分)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下:
_? aA (g)+ bB (g)  2C(g)
2C(g)
起始物质的量(mol):? 3? 2? 0
2s末物质的量浓度(mol/L): 0.9? 0.8? 0.4
则①a=?,b=?;
②2S内B的反应速率=?。
(3)(2分) 1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式?。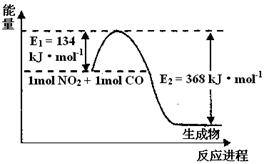
参考答案:(1)第三周期第ⅢA族(2分)
(2)①a=3(2分)? b="1" (2分)?②0.1mol/(L·S)(2分)
(3)NO2(g) + CO(g) =? CO2(g) + NO(g) △H =" -" 234kJ·mol-1(2分)
本题解析:(1)1.5mol氢气,共转移电子是1.5mol×2=3.0mol,所以该金属原子在反应中失去3铬电子。由于离子具有氖原子的电子层结构,因此金属的原子序数为13,即为铝元素,位于第三周期第ⅢA族。
(2)根据方程式可知A、B、C的浓度变化量分别是(mol/L)0.6、0.2、0.4,所以化学计量数之比为3︰1︰2,因此a=3,b=1。B的平均反应速率是 。
。
(3)根据图像可知,反应物的总能量高于生成物的总能量,所以是放热反应,反应热为134 kJ·mol-1-368 kJ·mol-1=- 234kJ·mol-1,所以反应的热化学方程式为NO2(g) + CO(g) =? CO2(g) + NO(g) △H =" -" 234kJ·mol-1。
本题难度:简单
3、选择题 在一定温度下,向体积恒定为2 L的密闭容器里充入2 mol M和一定量的N,发生如下?反应:M(g)+N(g) E(g)。当反应进行到4min时达到平衡,测得M的浓度为0.2 mol·L-1。下列说法正确的是
E(g)。当反应进行到4min时达到平衡,测得M的浓度为0.2 mol·L-1。下列说法正确的是
A.4 min时,M的转化率为80%
B.4 min时,用M表示的反应速率为0.8 mol·L-1·min-1
C.4 min后,向容器中充入不参与反应的稀有气体,M的物质的量减小
D.2 min时,M的物质的量浓度为0.6 mol·L-1
参考答案:A
本题解析:M的起始浓度为1mol/L,平衡为0.2mol/L,反应0.8mol/L,故转化率为80%;M的速率为0.8mol/L÷4min="0.2" mol·L-1·min-1;充入稀有气体,体积不变,不影响浓度;平衡不移动;只能算出平均速率,故中间状态浓度,不能求出。
本题难度:简单
4、填空题 液氨常用作制冷剂,回答下列问题
(1)一定条件下在密闭容器中发生反应:
a.NH4I(s)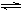 NH3(g) + HI(g)? b.2HI(g)
NH3(g) + HI(g)? b.2HI(g) 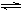 ?H2(g) + I2(g)
?H2(g) + I2(g)
①写出反应a的平衡常数表达式?
②达到平衡后,扩大容器体积,反应b的移动方向?(填“正向”、“逆向”或“不移动”),达到新的平衡时容器内颜色将怎样变化?(填“加深”、“变浅”或“不变”)
(2)工业上合成氨的反应:N2(g)+3H2(g) 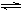 2NH3(g) ?ΔH=-92.60 kJ·mol-1
2NH3(g) ?ΔH=-92.60 kJ·mol-1
下列说法能说明上述反应向正反应方向进行的是________(填序号)。
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N—H键的同时生成2n mol H—H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
d.混合气体的平均摩尔质量增大
e.容器内的气体密度不变
(3)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据:
?时间(h)
物质的量(mol)
| 0
| 1
| 2
| 3
| 4
|
N2
| 1.50
| n1
| 1.20
| n3
| 1.00
|
H2
| 4.50
| 4.20
| 3.60
| n4
| 3.00
|
NH3
| 0
| 0.20
| ?
| 1.00
| 1.00
|
?
根据表中数据计算:
①反应进行到2 h时放出的热量为________ kJ。
②0~1 h内N2的平均反应速率为________ mol·L-1·h-1。
③此温度下该反应的化学平衡常数K=________(保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00 mol,化学平衡将向________方向移动(填“正反应”或“逆反应”)。
(4)肼(N2H4)的性质类似于NH3,极易溶于水,与水反应生成一种二元弱碱在溶液中分步电离,请用离子反应方程式表示其水溶液显碱性的原因?
参考答案:(1)① k=[NH3] [HI] ?② 正向?变浅(2) bd
(3)①27.78?②0.05 ③0.15?④正反应
(4)N2H4·2H2O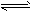 [N2H5·H2O]+?+ OH-
[N2H5·H2O]+?+ OH-
本题解析:(1)①根据题给反应a结合平衡常数表达式的书写原则写出,反应a的平衡常数表达式为k=[NH3] [HI];②反应a是反应前后气体体积增大的反应,反应b是反应前后气体体积不变,所以增大容器体积相当于压强减小,平衡向气体体积增大的方向移动,所以平衡向正反应方向移动,因为容器体积增大,平衡时I2(g)的浓度减小,气体颜色变浅;(2)a.单位时间内生成2nmolNH3的同时消耗3nmolH2,同时生成3n?molH2,该反应达到平衡状态,错误;b.当单位时间内生成6nmolN-H键同时消耗3nmolH-H键反应处于平衡状态,现同时生成2n?molH-H键,则平衡向在反应方向移动,正确;c.反应处于任何状态,用N2、H2、NH3的物质的量浓度变化表示的反应速率之比均等于化学计量数之比,为1:3:2,不能确定该反应向正反应方向移动,错误;d.混合气体的平均摩尔质量增大,则平衡向气体体积减小的正反应方向移动,正确;e.混合气体质量不变,容器体积不变,所以容器内的气体密度始终不变,错误;选:bd;(3)①根据题给数据分析,反应进行到2 h时生成氨气0.6mol,结合题给热化学方程式计算放出的热量为27.78 kJ;②根据题给数据分析,0~1 h内N2的物质的量变化为0.1mol,根据公式v=Δn/VΔt计算,平均反应速率为0.05 mol·L-1·h-1;③根据题给数据分析,反应达到平衡后c(NH3)=0.5mol/L,c(N2)=0.5mol/L,c(H2)=1.5mol/L,化学平衡常数K=[NH3]2/[N2][H2]3=0.15;④反应达到平衡后,再加入N2、H2和NH3各1.00 mol,c(NH3)=1mol/L,c(N2)=1mol/L,c(H2)=2mol/L,浓度商Q=0.125<K,则平衡向正反应方向移动;(4)肼(N2H4)的性质类似于NH3,极易溶于水,与水反应生成一种二元弱碱N2H4?2H2O,电离方程式为:N2H4?2H2O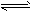 [N2H5?H2O]++OH-。
[N2H5?H2O]++OH-。
本题难度:一般
5、选择题 在一定温度下,反应1/2H2(g)+ 1/2X2(g) 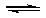 HX(g)的平衡常数为10。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于
HX(g)的平衡常数为10。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于

A.5%
B.17%
C.25%
D.33%
参考答案:B
本题解析:1/2H2(g)+ 1/2X2(g) 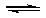 HX(g)的平衡常数K1为10,那么HX(g)
HX(g)的平衡常数K1为10,那么HX(g) 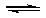 1/2H2(g)+ 1/2X2(g) 的平衡常数K2为1/10, 2HX(g)
1/2H2(g)+ 1/2X2(g) 的平衡常数K2为1/10, 2HX(g) 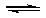 H2(g)+ X2(g) 的平衡常数K3为(1/10)2=0.01.设HX(g)分解xmol/L,有, 2HX(g)
H2(g)+ X2(g) 的平衡常数K3为(1/10)2=0.01.设HX(g)分解xmol/L,有, 2HX(g) 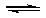 H2(g)+ X2(g)
H2(g)+ X2(g)
 ? 1? 0? 0
? 1? 0? 0
 ? x? x? x
? x? x? x
 ? 1-x? x? x
? 1-x? x? x
 K3= x·x/(1-x) 2=" 0.01" ,得到x=0.17,所以,该温度时HX(g)的最大分解率接近于B. 17%
K3= x·x/(1-x) 2=" 0.01" ,得到x=0.17,所以,该温度时HX(g)的最大分解率接近于B. 17%
本题难度:一般